
大家好,我是来自上海交通大学医学院附属第六人民医院的郑晓皎。很高兴受到热心肠的邀请,来和大家分享我们课题组的最新研究。
我们长期关注小分子代谢物在发病机制和药物开发方面的研究,今天想和大家探讨的是脂肪肝,我们怎么样去利用小分子的胆汁酸来进行肝病肠治。

我们知道,随着社会经济的发展和人民生活水平的提高,脂肪肝的发病率其实逐年增加,可以说是生活中最常见的慢性疾病之一。
根据流行病学数据显示,每4个人当中就有1个脂肪肝患者。如果在肥胖或者糖尿病人群中,这个比例就更加惊人了。
脂肪肝这个病其实涵盖了一系列疾病的进展。早期的单纯性脂肪肝是一个可逆性疾病,但是如果进展到了非酒精性脂肪性肝炎(NASH),甚至到肝硬化、肝功能衰竭,就会造成不可逆的损伤,乃至死亡。
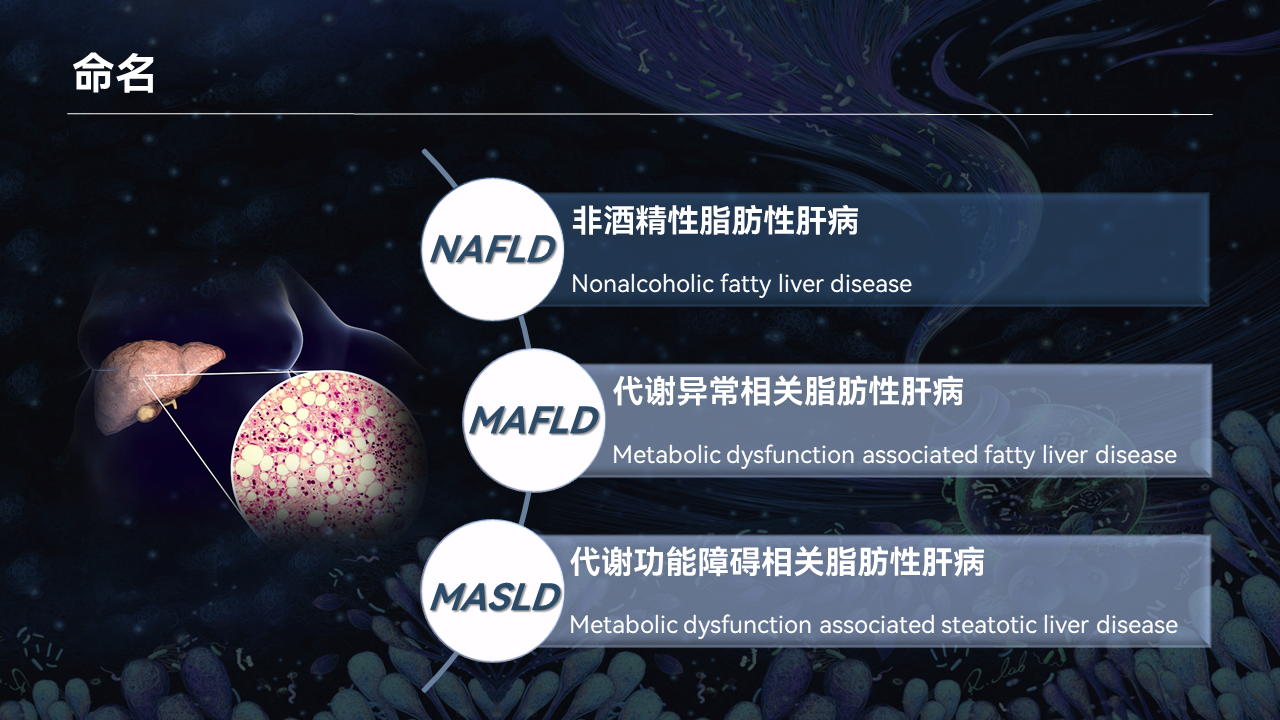
全世界的临床和科研专家都给予了脂肪肝很高的关注度,这一点从脂肪肝不断更新的命名就可以看出。
我们平时最常使用的是“非酒精性脂肪性肝病”(NAFLD),前几年多国专家提出新命名——“代谢异常相关脂肪性肝病”(MAFLD),2023年欧洲肝脏研究学会年会(EASL2023)再次修正为“代谢功能障碍相关脂肪性肝病”(MASLD)。
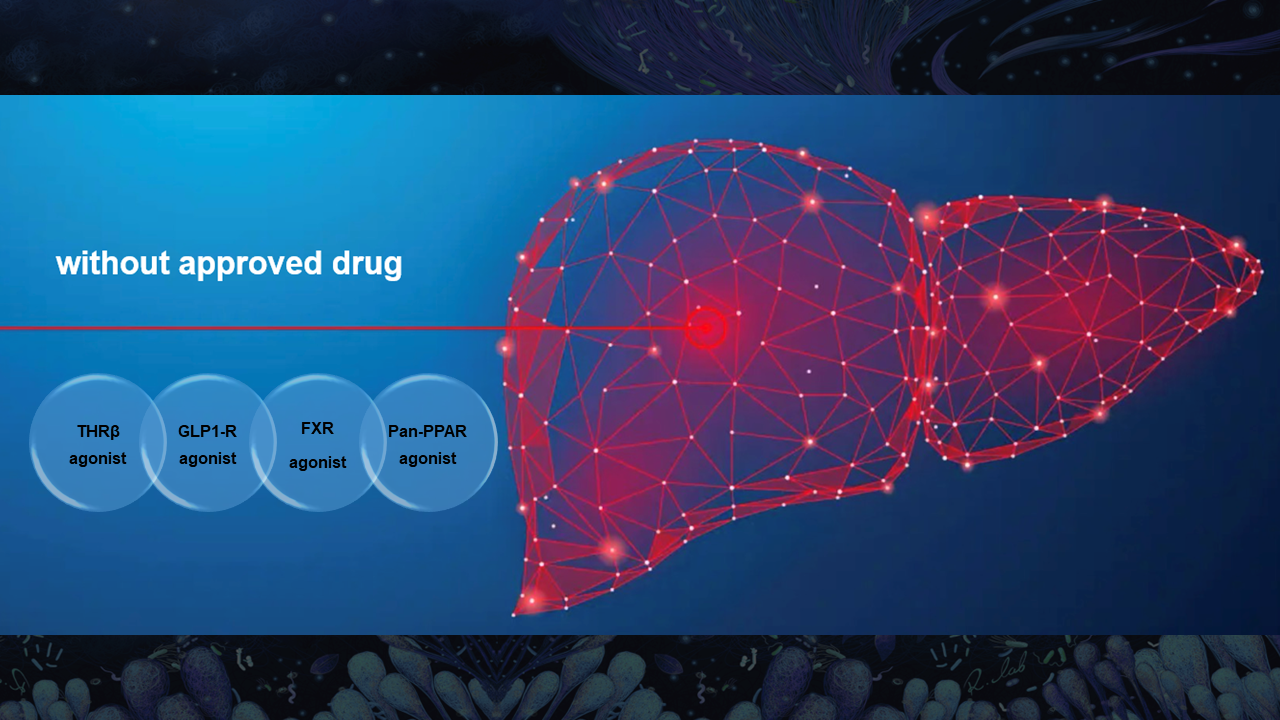
但是这一个疾病,特别是NASH阶段的治疗,其实到目前为止还没有临床批准的药物。我在这里罗列了一些已经推向临床三期的药物靶点,包括像甲状腺素受体β、GLP1、FXR、Pan-PPAR等受体。
这些受体的激动剂药物,有一些正在进行临床三期试验;有一些已经取得了很好的临床效果,比如说最近报道比较多的甲状腺素受体β激动剂;但是有一些药物因为副作用,已经被终止或暂缓。
所以对于脂肪肝药物的研发,我们依然有很长的路要走。
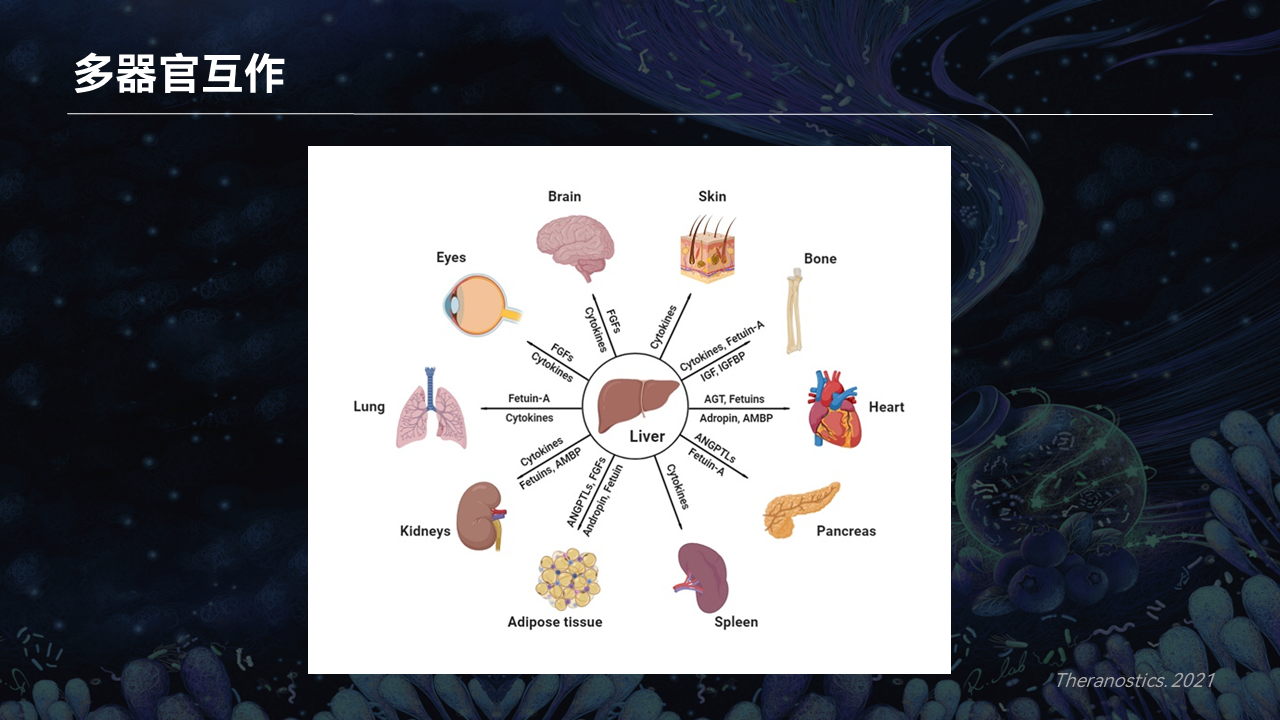
人体是一个非常复杂的综合系统,肝脏作为一个多效应器官,其实和全身各个组织不断地在进行交流对话。
越来越多的研究也显示,肝病治疗的靶点可能不仅仅在肝脏,远端器官的信号最终会反馈到肝脏,达到治疗肝病的目的。
我们的课题组负责人,也是我的导师贾伟教授,曾在2019年的《肠·道》演讲中强调了肝病肠治的重要性,特别指出肠道中丰富的菌群是肝病进展的幕后推手。
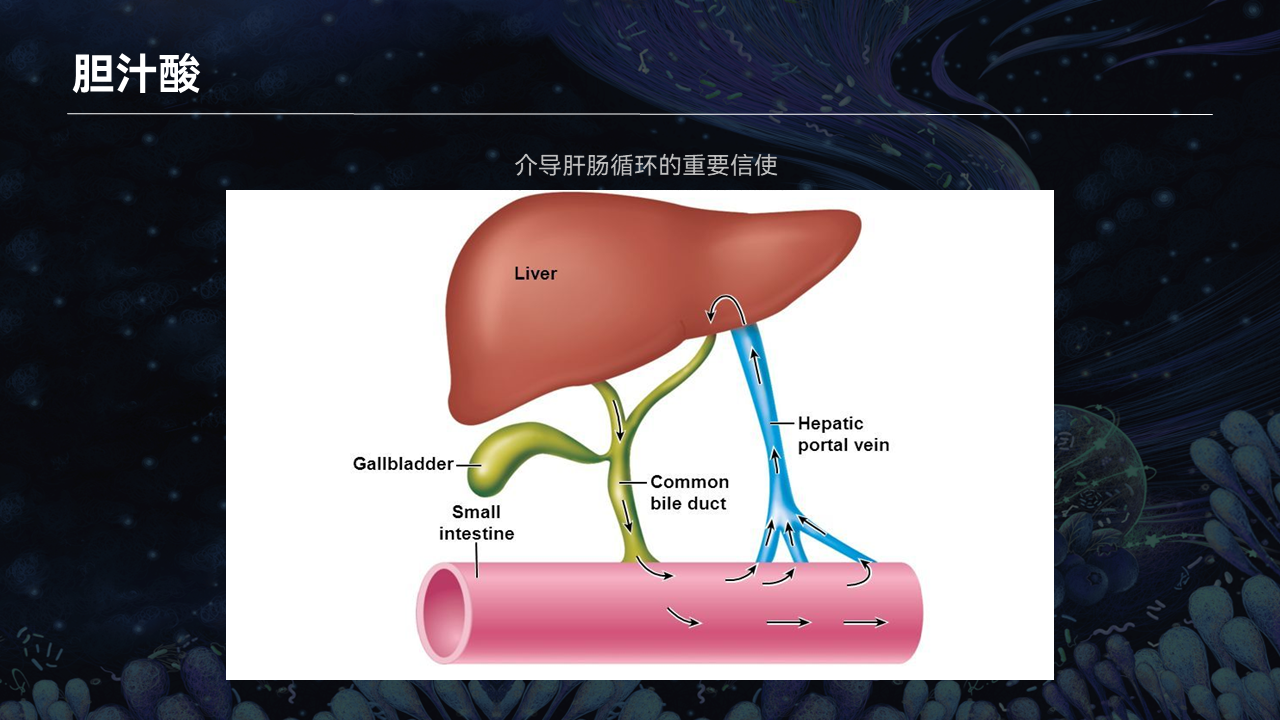
其实我们从解剖结构上就不难发现,肝脏和肠道是有密切的相关性的。
肝脏负责过滤全身循环的血液,其中大部分都来源于肠道。所以我们可以说,肝脏是面对或者接受肠道物质的第一个肠外器官。
肝脏和肠道之间存在着肝肠循环。胆汁,特别是胆汁中的胆汁酸,扮演着非常重要的角色。在每天10次左右的肝肠循环中,胆汁不但负责进行脂质的消化、吸收,其中的胆汁酸还发挥着重要的代谢、免疫的调节功能。
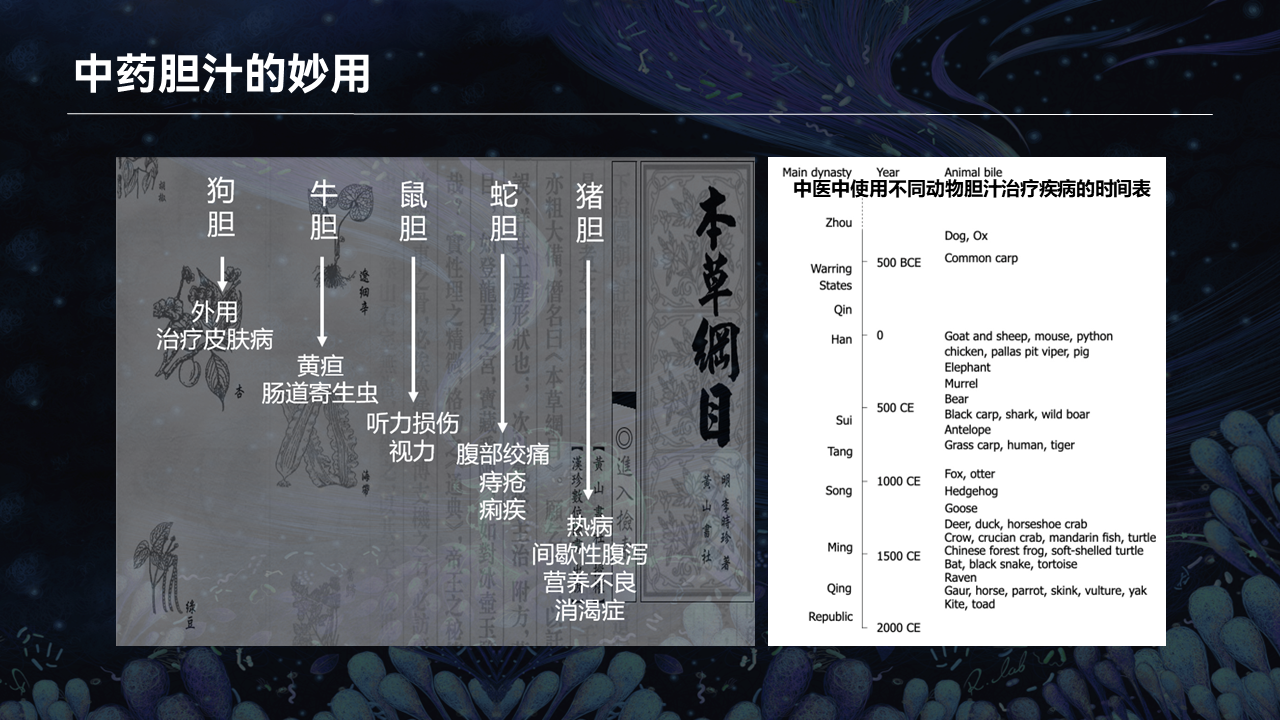
其实说到胆汁,我们中华民族几千年前就意识到胆汁的重要性。
我们可以看到,很多动物的胆汁都是宝贵的中药药材,可以外用也可以内服,发挥着多种多样的疗效。

古方有记载,猪胆汁寒能泻热,滑能润肠,苦人心,去肝胆之火。如果消渴无度,可煎服雄猪胆。
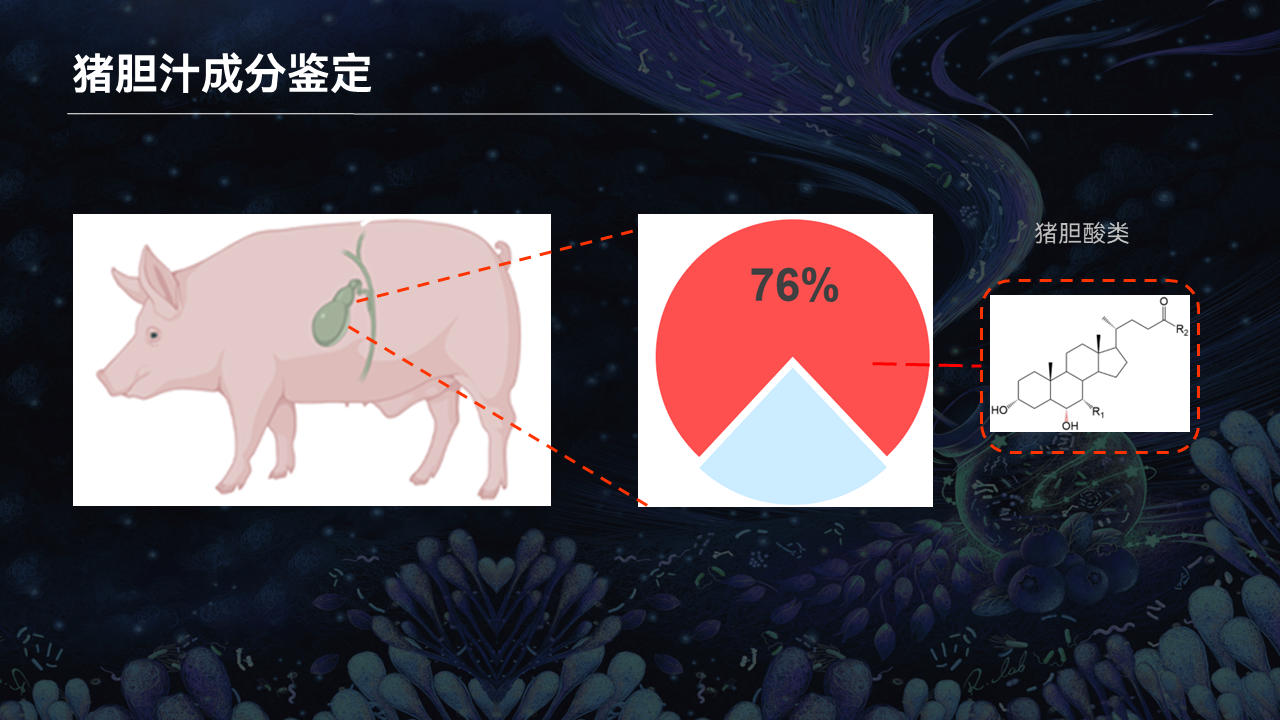
我们课题组关注到猪胆和代谢性疾病治疗的密切关系,因此对开展了一系列的研究。
首先我们利用现代的色谱质谱技术,对猪胆的胆汁酸成分进行了精确定量。
我们惊讶地发现,猪胆中有一类6α-羟基胆汁酸,在我们人体和小鼠体内其实含量很低,不足5%,而在猪的体内可以达到总胆酸的将近80%。我们称这一类胆汁酸为猪胆酸类。
发现猪胆的重要代谢调节成分
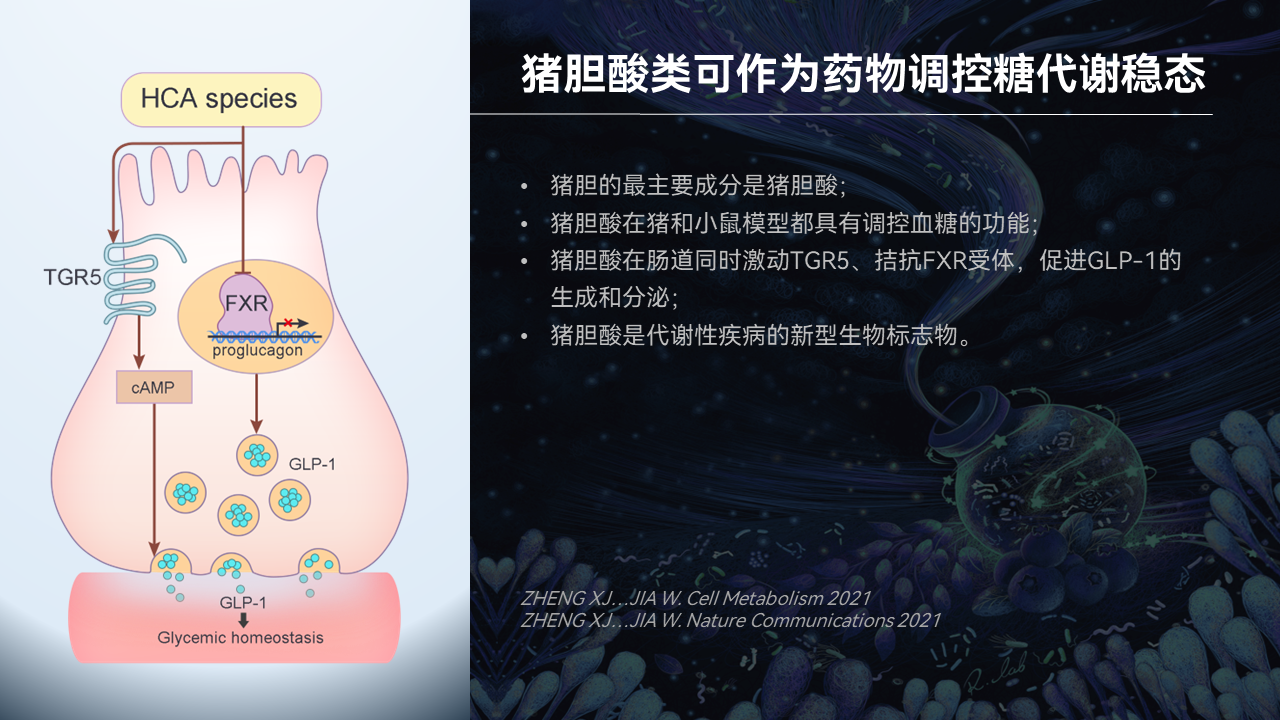
通过系统的研究,我们突破性地发现,猪胆酸类正是猪胆治疗消渴症,也就是现在我们说的糖尿病的重要物质基础。
这类物质在猪和小鼠体内都具有调控血糖的功能,主要作用靶点就是肠道。它可以通过对肠道L细胞的两个胆汁酸受体的调控,来促进胰高血糖素样肽-1(GLP-1)的生成和分泌。
此外我们还发现,猪胆酸类是代谢性疾病的新型生物标志物。
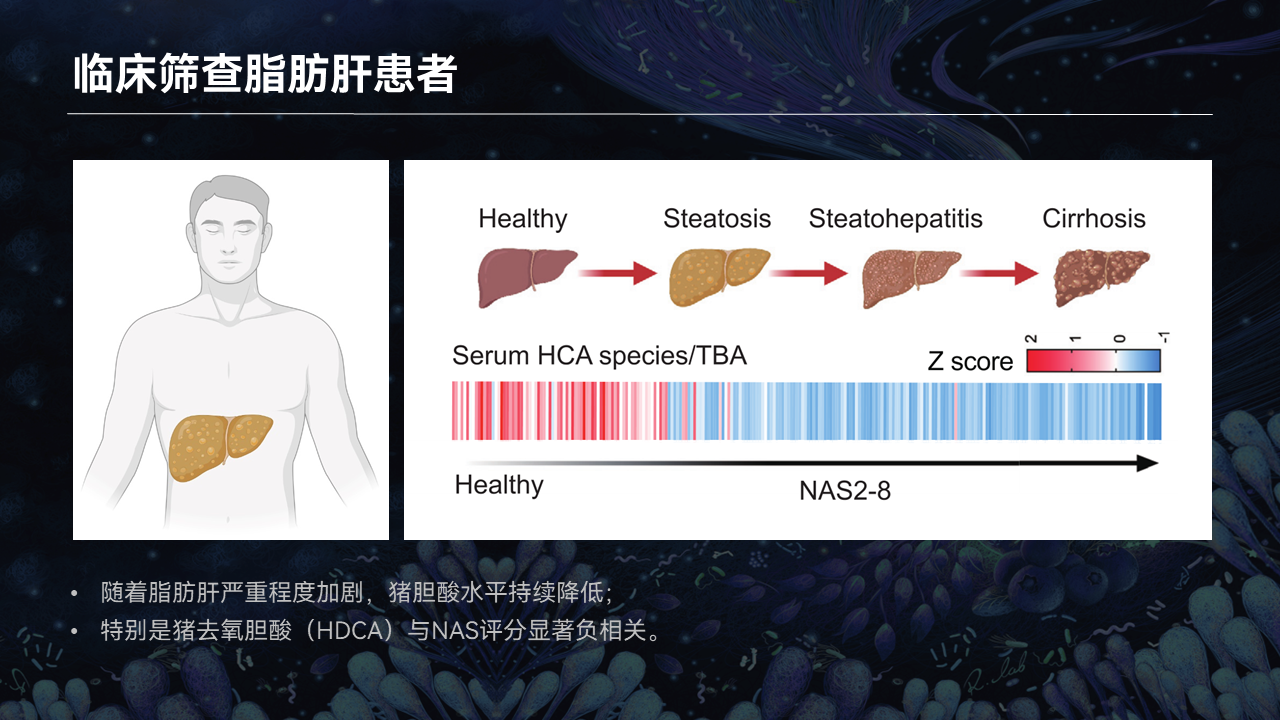
回到脂肪肝的研究中,我们首先对脂肪肝患者进行了胆汁酸筛查。
我们发现,随着临床病人脂肪肝严重程度的加剧,这类猪胆酸的水平是持续降低的。尤其值得注意的是,其中的猪去氧胆酸(HDCA)与非酒精性脂肪性肝病活动度评分(NAS)呈现着最显著的负相关性。
这一现象,我们在小鼠体内也得到了验证。
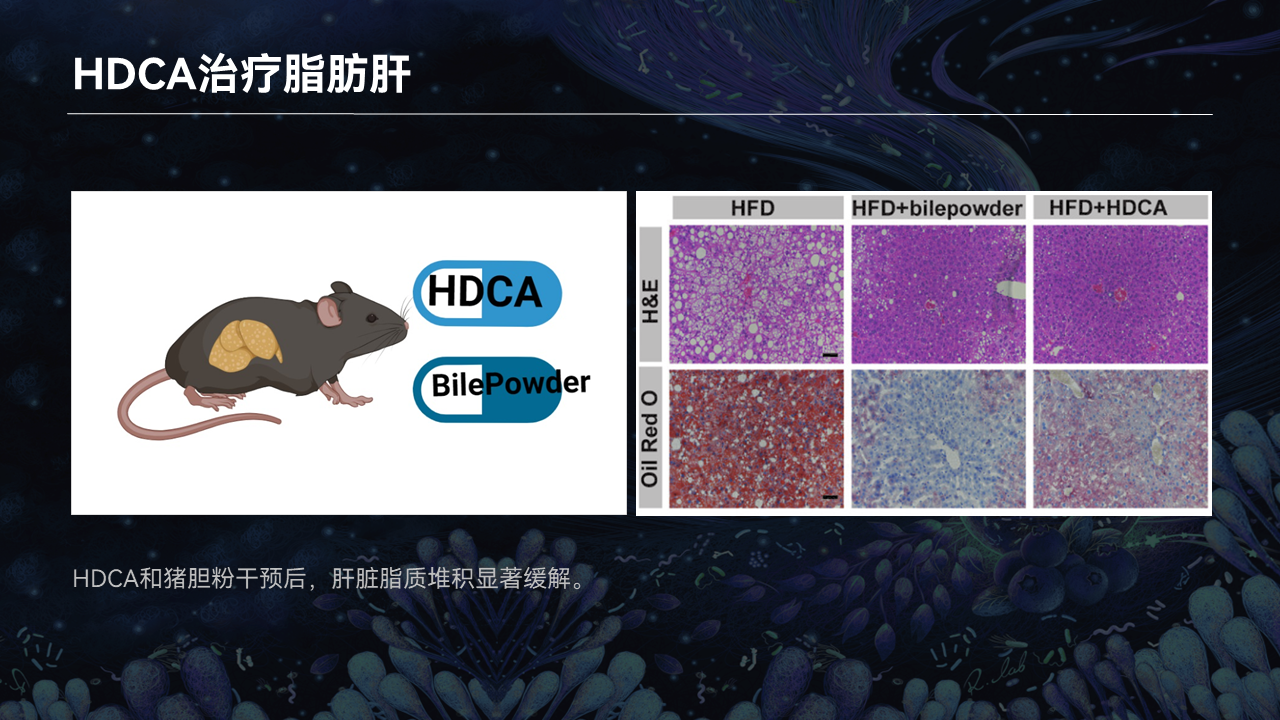
如果去回补HDCA,是否能够缓解脂肪肝的表型呢?
因此我们去造了脂肪肝小鼠的模型,去给予小鼠HDCA和猪胆粉。猪胆粉就是猪胆的干燥粉末,里面富含着HDCA。
我们发现干预8周以后,小鼠的脂肪肝表型确实得到了显著的缓解。

另外我们还选用了两种胆汁酸类药物作为对照,一个是已经推到临床三期被叫停的奥贝胆酸(OCA),另外一个是在临床已经广泛使用治疗肝胆疾病的熊去氧胆酸(UDCA)。
干预结果显示,HDCA缓解脂肪肝的疗效要优于这两类药。
确定HDCA治疗靶点在肠道
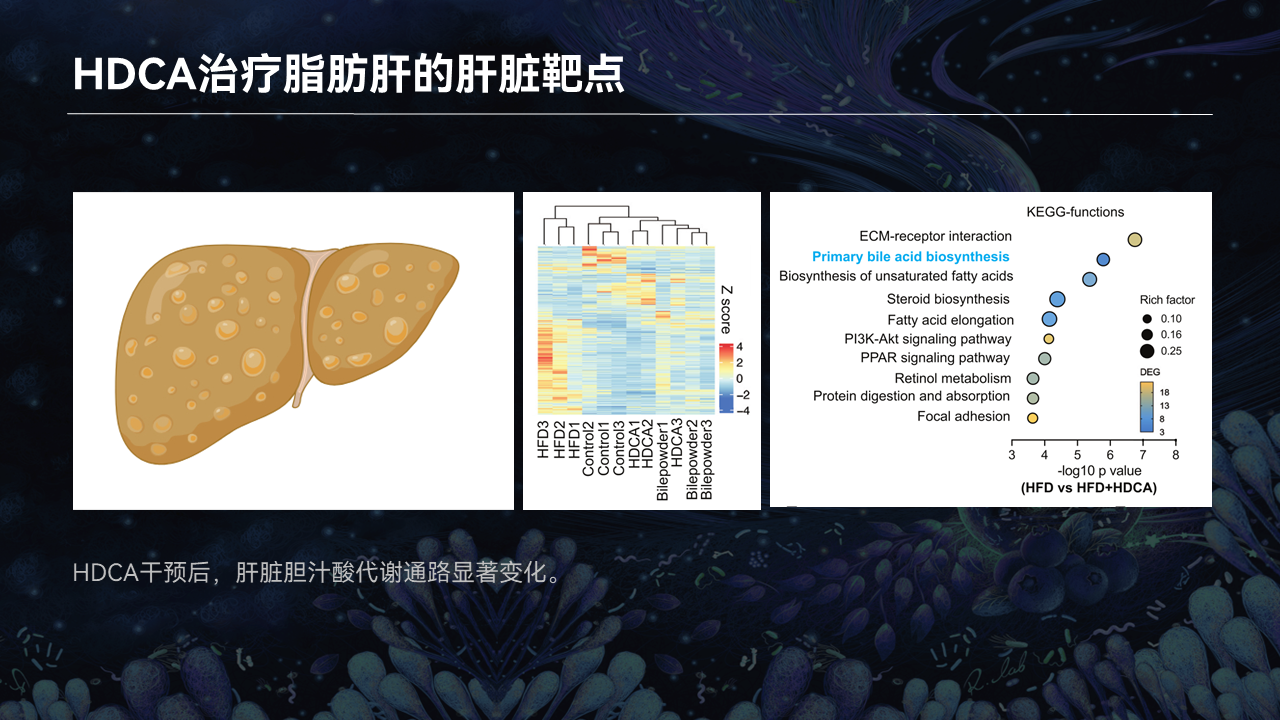
接下来我们寻找HDCA治疗脂肪肝的肝脏靶点。
我们对小鼠的肝脏进行了RNA测序检测发现,HDCA干预以后,肝脏胆汁酸的合成通路发生了显著的变化。
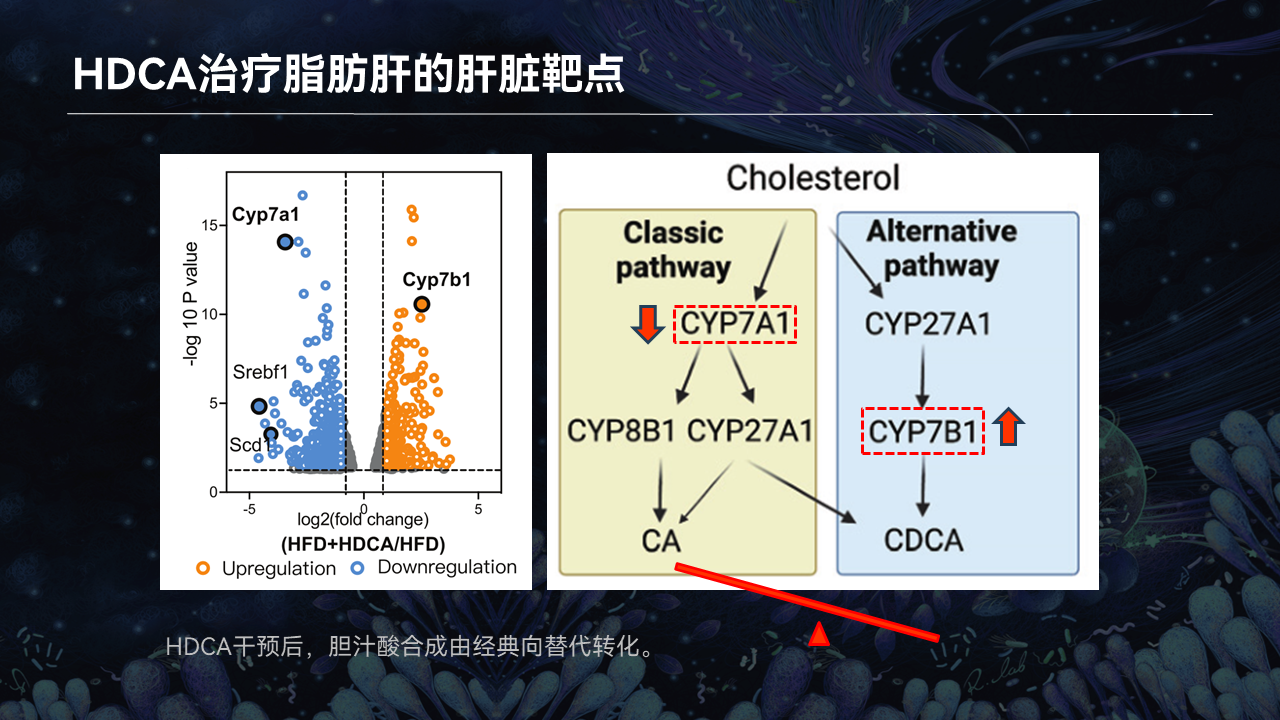
我们可以看到,胆汁酸的肝脏合成通路分成经典途径和替代途径两条通路。
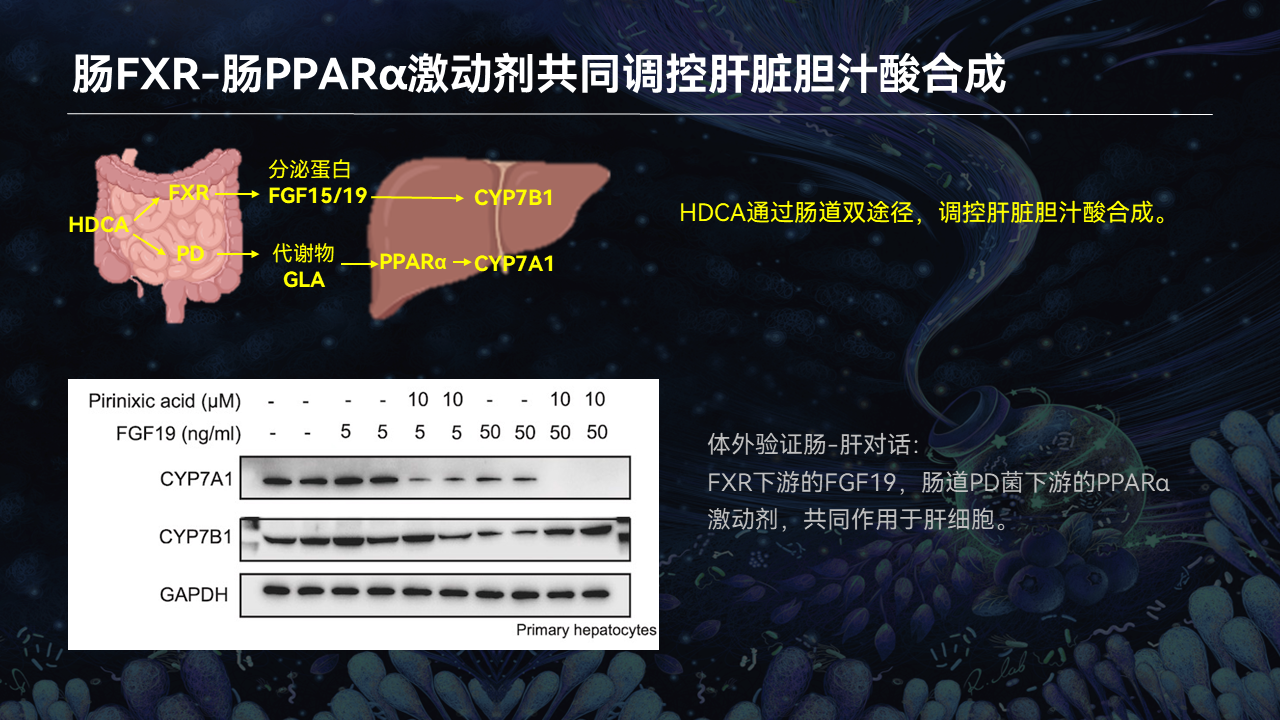
数据显示,在HDCA干预以后,经典通路里的CYP7A1是显著下降的,而替代通路中的CYP7B1显著上升。
可见HDCA干预以后,胆汁酸的合成通路是由经典向替代转化的一个过程。
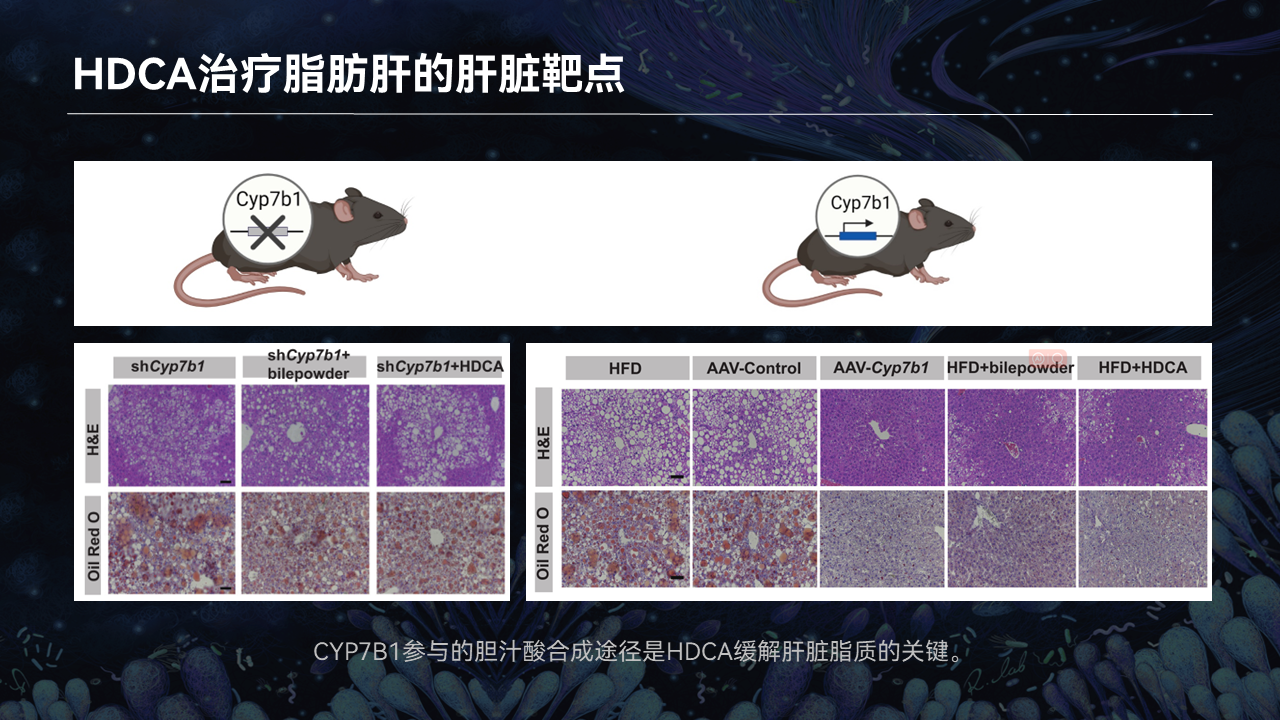
我们对关键的肝酶CYP7B1进行干预发现,当靶向地敲除肝脏的CYP7B1以后,HDCA的疗效就不再显著。
反过来,如果我们把一些CYP7B1过表达,即使不用HDCA干预,也能模拟出HDCA治疗脂肪肝的疗效。
因此我们说,CYP7B1参与的胆汁酸合成途径是HDCA治疗脂肪肝的关键。
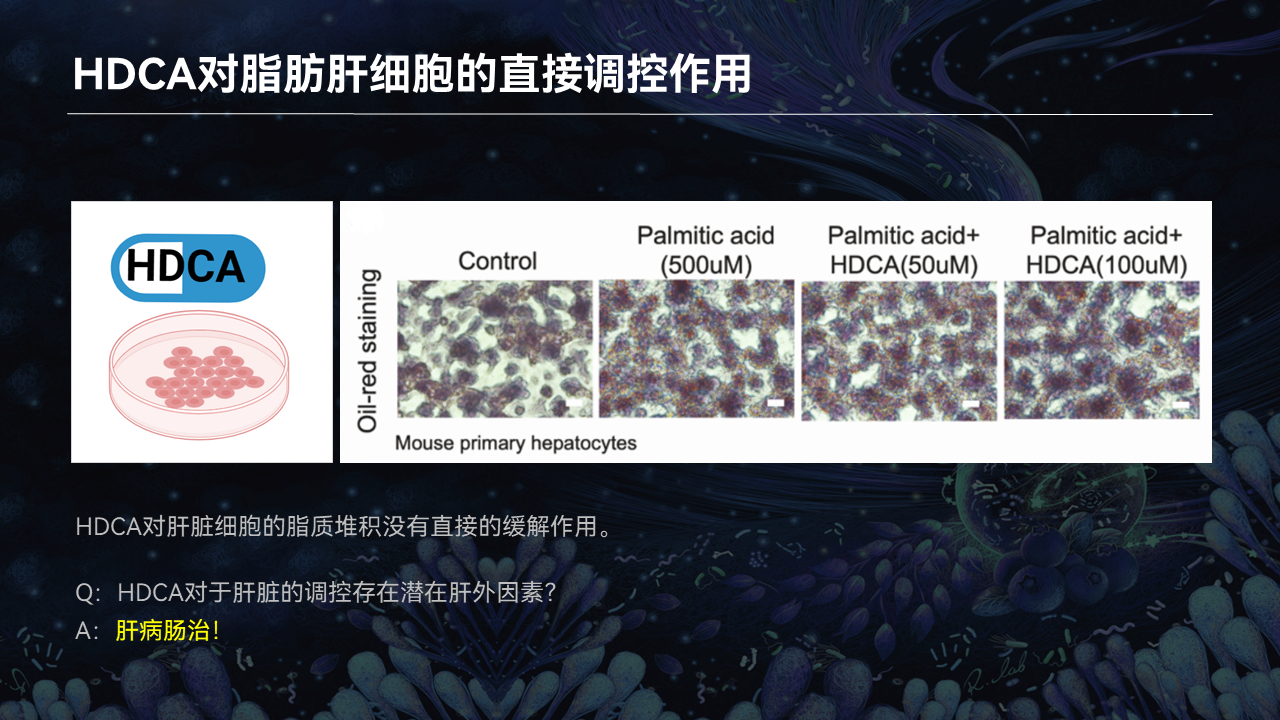
那么HDCA是否直接作用于肝细胞,来缓解肝脏脂质堆积呢?
我们就把小鼠的原代肝细胞分离出来,用棕榈酸进行干预,造脂肪肝的细胞模型。在这个基础上,再用HDCA去干预。
结果我们发现和体内不一致的情况:在细胞实验上,HDCA对于肝脏脂质的堆积并没有显著的缓解效果。所以我们提出,HDCA对于肝脏调控的直接靶点并不在肝脏,是存在着肝外因素。
这个答案就是我们开头提及的“肝病肠治”,也就是靶点在肠道。
我们知道,肠道环境是非常复杂的。肠道细胞种类繁多,包括像上皮、神经、免疫、内分泌等等各种各样多样的细胞,同时肠腔里的肠道细菌更是纷繁复杂,值得我们深入地研究。
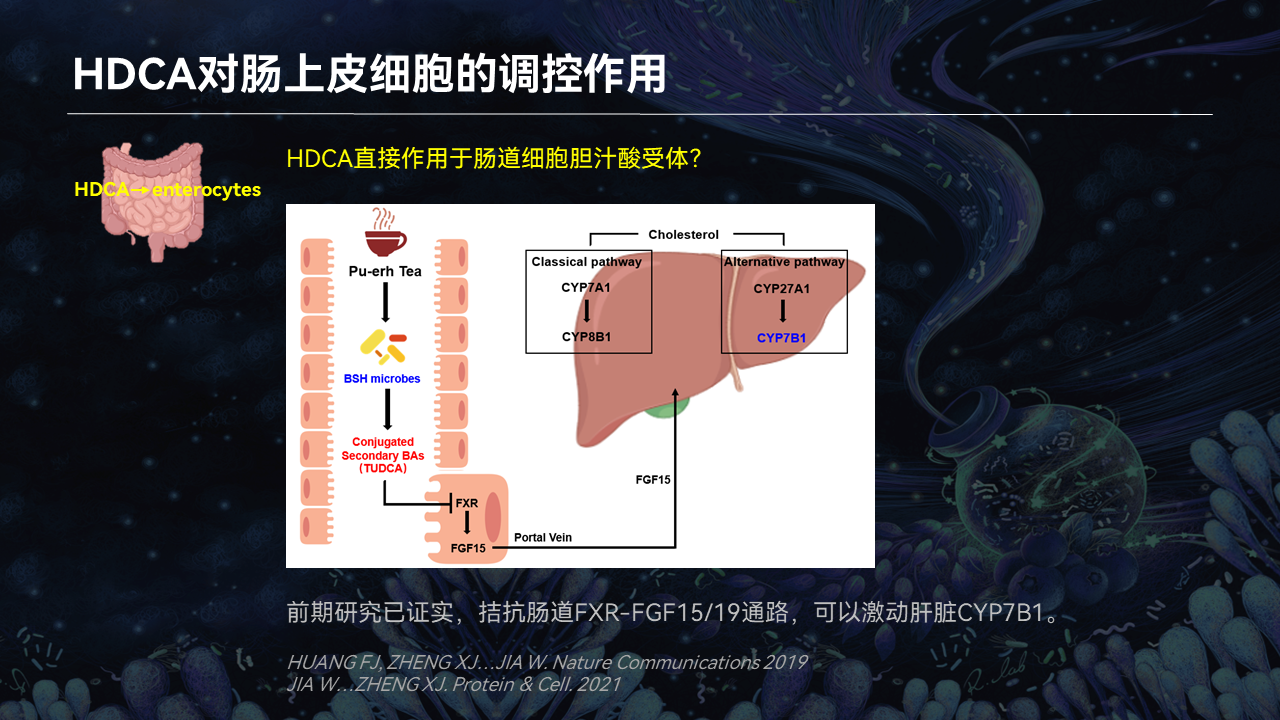
我们首先从肠道细胞入手,去观察HDCA对于肠道里面量比较高的上皮细胞中的胆汁酸受体的调控作用。
我们的前期结果已经证实了,胆汁酸是可以通过拮抗肠道上皮细胞的FXR信号通路,来激活肝脏CYP7B1的表达。
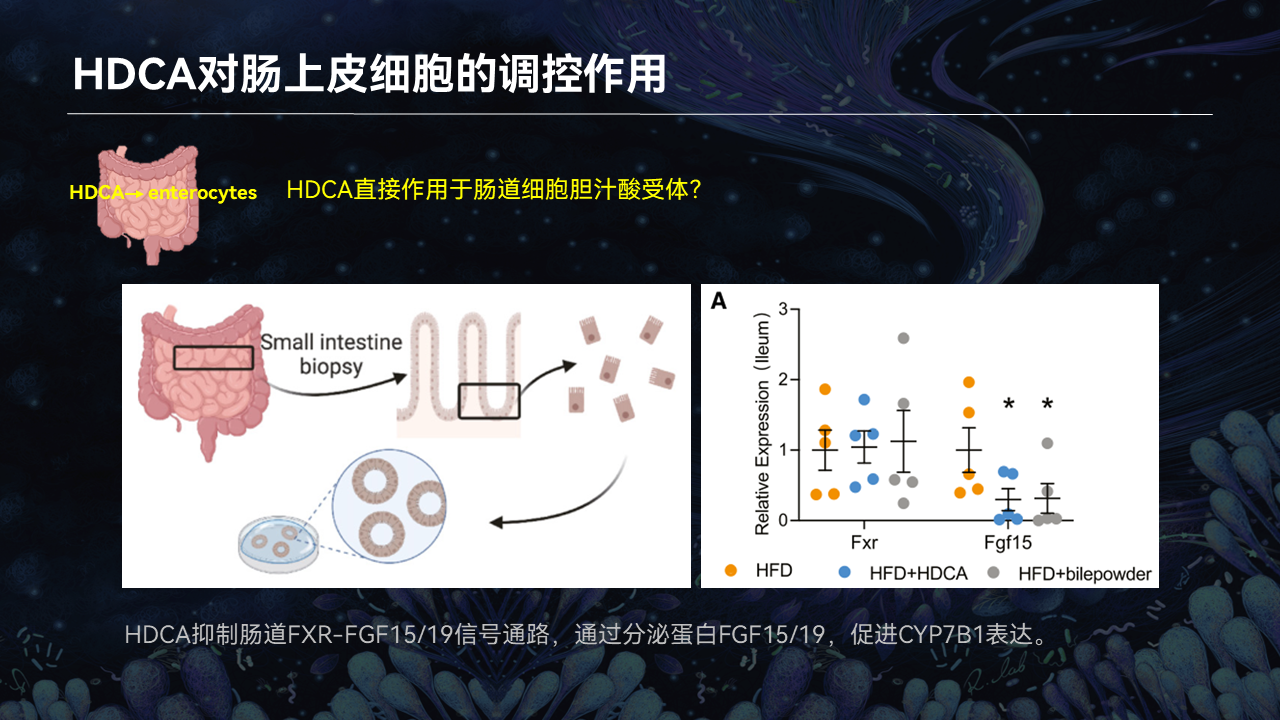
所以我们考察了,蛋白、细胞和活体水平上HDCA对于肠道FXR的作用。
我们证实了HDCA确实可以抑制肠道FXR以及它下游的分泌蛋白FGF15/19信号通路,通过分泌蛋白来促进肝脏CYP7B1的表达。

为了验证这一发现,我们选用了肠道FXR靶向的拮抗剂Gly-MCA(甘氨酸-β鼠胆酸),去干预进行验证。
结果我们发现,如果单纯地只去抑制肠道的FXR,其实肝酶CYP7A1、CYP7B1是同时上调的,而不像HDCA干预以后是CYP7B1上调、CYP7A1下调。
这个不一致的结果又提示我们,可能存在其他下调CYP7A1的因素。
阐明HDCA的肠道调控机制

2017年,我们课题组发表过一篇论文提出,胆汁酸是调控肠道菌群组成的重要的始动因素。
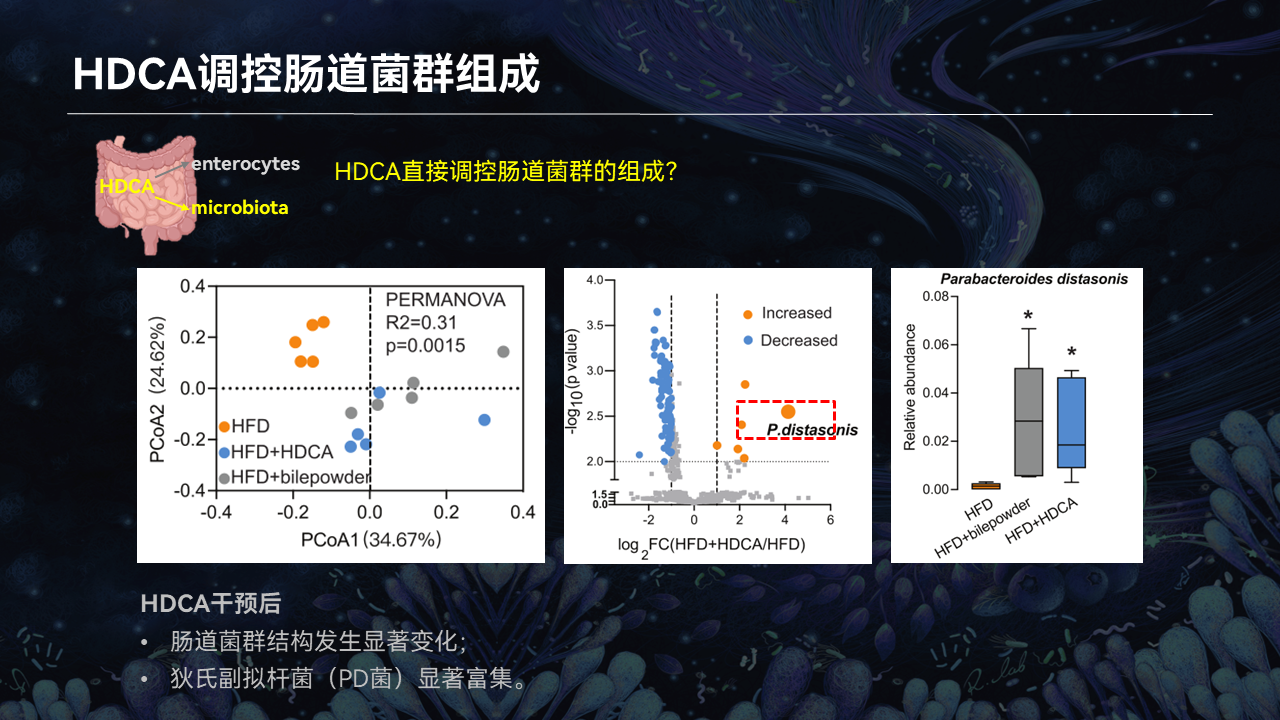
那么HDCA干预是否直接调控肠道菌群的组成,进而去影响肝酶?
所以我们对小鼠的肠道内容物进行了宏基因组检测,我们发现HDCA干预以后,肠道菌群的结构确实发生了显著变化,特别是狄氏副拟杆菌(PD菌),它是显著的富集。
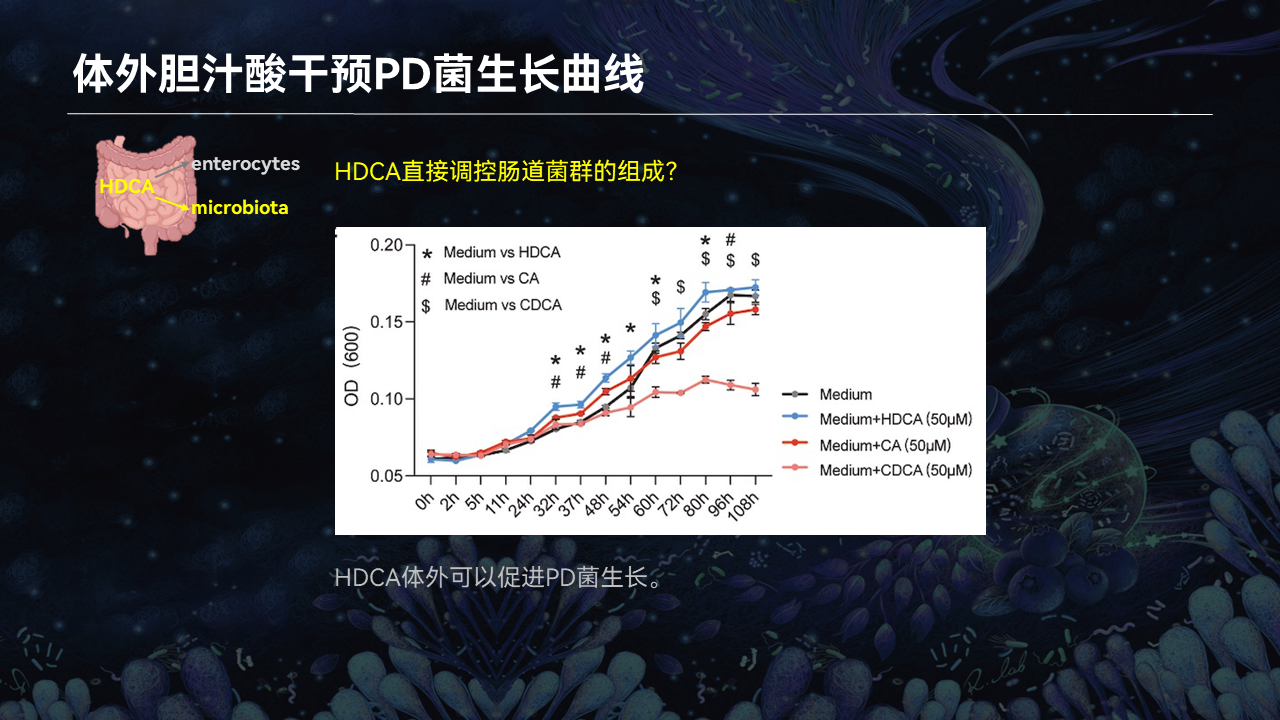
在体外细菌培养实验中,我们也证实了HDCA确实可以促进PD菌的生长。

进一步我们将PD菌干预脂肪肝小鼠模型发现,PD菌可以重复出HDCA治疗脂肪肝的效果。
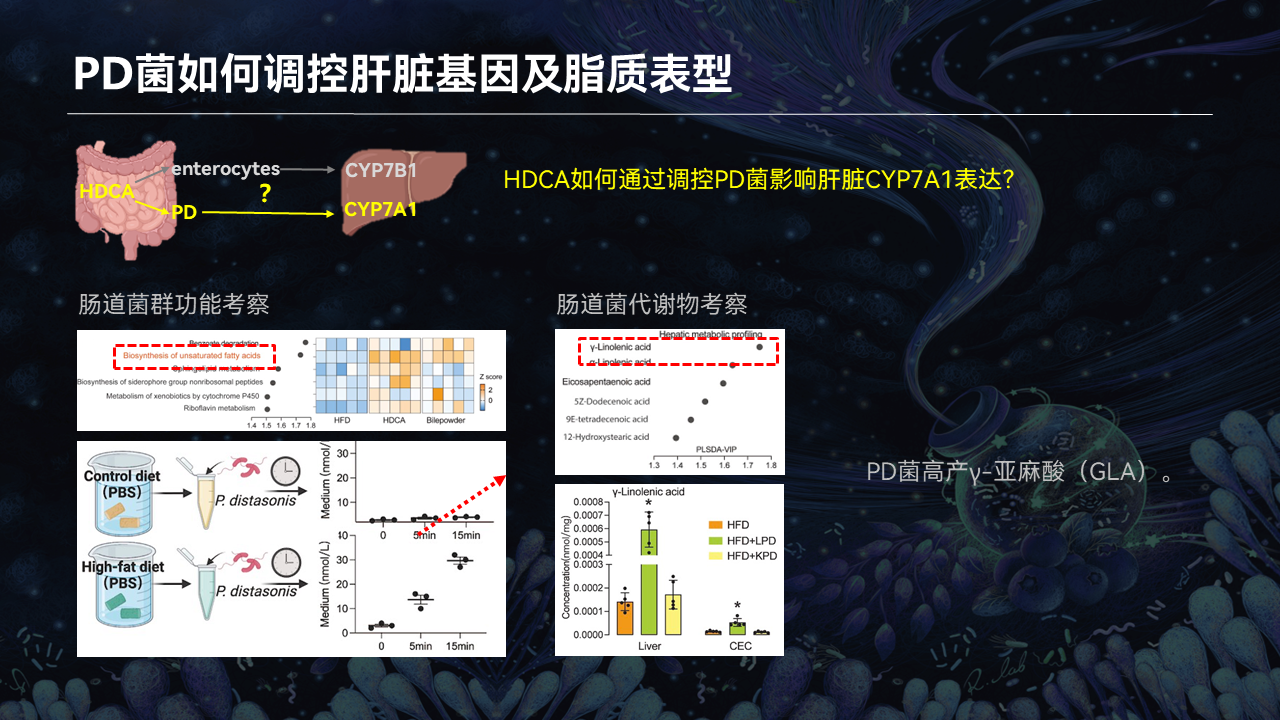
接下来我们要问的问题是,HDCA调控的PD菌有什么作用?是否能够影响肝脏,特别是肝脏的CYP7A1酶?
我们对肠道菌群的功能进行了考察发现,菌群不饱和脂肪酸合成的功能显著提高。利用代谢组学进行筛选,我们发现,不饱和脂肪酸γ-亚麻酸的水平在肠道和肝脏都显著升高。
通过体外实验证实,PD菌具有产γ-亚麻酸的能力。

为了考察PD菌产的γ-亚麻酸是不是会影响肝酶的表达,我们又回到了RNA测序数据,对肝脏的转录因子进行分析。结果发现PPAR通路显著变化,而有意思的是,脂肪酸恰恰是PPARα的配体。
在这个基础上我们做了一系列的研究,最终证实,γ-亚麻酸是可以激活肝脏转录因子PPARα,进而来抑制CYP7A1的转录。
故事讲到这里,差不多接近了尾声。
最后我们用了一个体外实验来验证,HDCA通过肠道的两条途径调控肝脏胆汁酸的合成。也就是肠道FXR下游的FGF19,以及肠道PD菌下游的PPARα激动剂,共同作用于肝脏细胞。
最后我对我们的故事做一个小结。
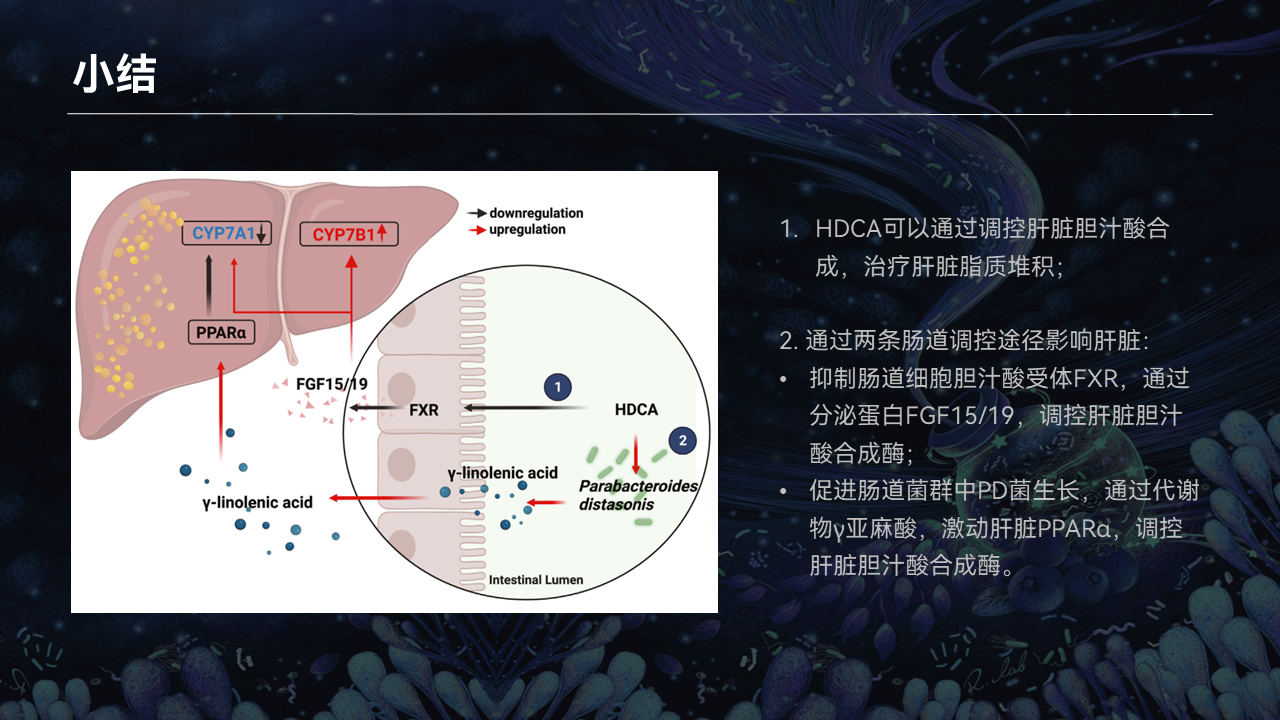
我们发现,HDCA可以通过调控肝脏胆汁酸合成的经典和替代途径的转化,治疗肝脏脂质堆积。具体来说,HDCA是直接作用于两条肠道调控途径,最终影响肝酶。
第一条途径是通过抑制肠道上皮细胞的胆汁酸受体FXR,通过分泌蛋白FGF15/19到达肝脏,来调控肝脏CYP7B1。
第二条途径是通过促进肠道PD菌的生长,产生下游的代谢物γ-亚麻酸,激动肝脏的PPARα,调控肝脏的CYP7A1。

我们的研究于2023年8月在Cell Metabolism发表,也很有幸看到Nature Reviews的两个重磅期刊把我们的研究作为亮点来报道。
看好HDCA的成药价值

我们认为HDCA有非常好的成药价值。
首先,它是一个多靶点药物,能够同时实现降脂、降糖、抗炎。
第二,它是GLP-1的促泌剂,和现在的GLP-1药物相比,在给药途径、保存运输方面都有着它独有的优势。
第三,它是内源性代谢物,药用价值高而且毒性很低。

最后来回顾一下HDCA治疗脂肪肝的研究历程。
我们从7年前最初探索发现,胆汁酸紊乱推动了肝病进展。一直到5年以前,我们逐渐关注到12羟基和非12羟基,也就是经典和替代的胆汁酸的平衡,与代谢性疾病,特别是肝病有密切的关系。
最近几年,我们一直把目光聚焦在一类非12羟基胆汁酸,也就是猪胆酸上,发现猪胆酸可以通过多靶点来调控糖脂代谢和免疫。

以上就是我和大家的一些分享,希望我们的研究案例能给大家一些启示,我们也会在猪胆酸临床转化中做更大的努力。
谢谢大家!


