唾液正成为早期癌症检测的一种有前途的工具。研究人员发现,唾液中存在的某些生物标志物可以指示身体中癌症的存在。
今天,我们共同关注唾液检测。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
在20世纪50年代末期,当时年仅30多岁的牙医、美国海军上校Kirk C. Hoerman试图回答一个问题:前列腺癌患者的唾液是否具有与健康人不同的特征?它是否可能包含一种与正常口腔完全不同的疾病特征痕迹?
Hoerman和他在美国伊利诺伊州大湖海军训练中心口腔研究部门的同事们没有浪费太多力气进行繁琐的讨论,而是决定直接上手研究。他们分析了来自200多名患者和健康对照组的样本,并发现未经治疗的前列腺癌患者的唾液中酸性磷酸酶的水平显著增加1。
1959年,研究人员在Cancer杂志上发表了论文2,提出了一个有先见之明的想法:在远离肿瘤病灶的组织中观察离散的生化指标变化可能很有价值。
60多年后,唾液分析可用于检测不同类型癌症的想法在科学界越来越受到重视。生物医学研究论文数据库PubMed显示,在专业文献中,包含“诊断(diagnosis)”、“癌症(cancer)”和“唾液(saliva)”等关键词的论文在过去20年里增长了10倍以上,从2001年的26篇到2011年的117篇、2016年的183篇、2021年的319篇。
这种方法的吸引力是显而易见的。虽然癌症可以通过组织活检来进行诊断,但这需要训练有素的医生挥舞长针、手术刀、内窥镜或其他工具来“撬动”人体进行取样。液体活检3,即在血液、尿液、脑脊液、精液或唾液等液体中寻找肿瘤成分的痕迹,是一种侵入性较低的替代方法。其中,最易采集的样本无疑是唾液。
这种方法已经取得了成效:2021年,FDA授予了美国Viome公司开发的一种基于唾液的口腔癌和咽喉癌预诊断工具创新设备的称号。这类称号特别授予那些有潜力为危及生命的疾病提供更有效治疗或诊断的新型医疗设备。该工具利用人工智能和机器学习,分析唾液样本中的口腔细菌群落的基因活动(特别是mRNA)。由于某些未知的原因,当嘴唇、舌头、喉咙或周边区域发生肿瘤时,这个群落就会发生改变。
“几十年来,唾液被认为是血液的候补者。”化学家Chamindie Punyadeera(现在澳大利亚格里菲斯大学任职)认为。她花了10年时间研究Viome的唾液诊断测试,并是相关成果的主要作者之一。该成果于2021年发表在npj Genomic Medicine期刊4。
但是,随着唾液分析技术的进步,以及对唾液所能承载哪些信息的更好理解,这种将唾液视为“候补者”的观点在未来几年可能会开始改变。Punyadeera表示,唾液可以无创收集,并且有自主行动能力的患者可以自行采集多个样本,因此患者可以成为他或她自己诊断测试的管理者。
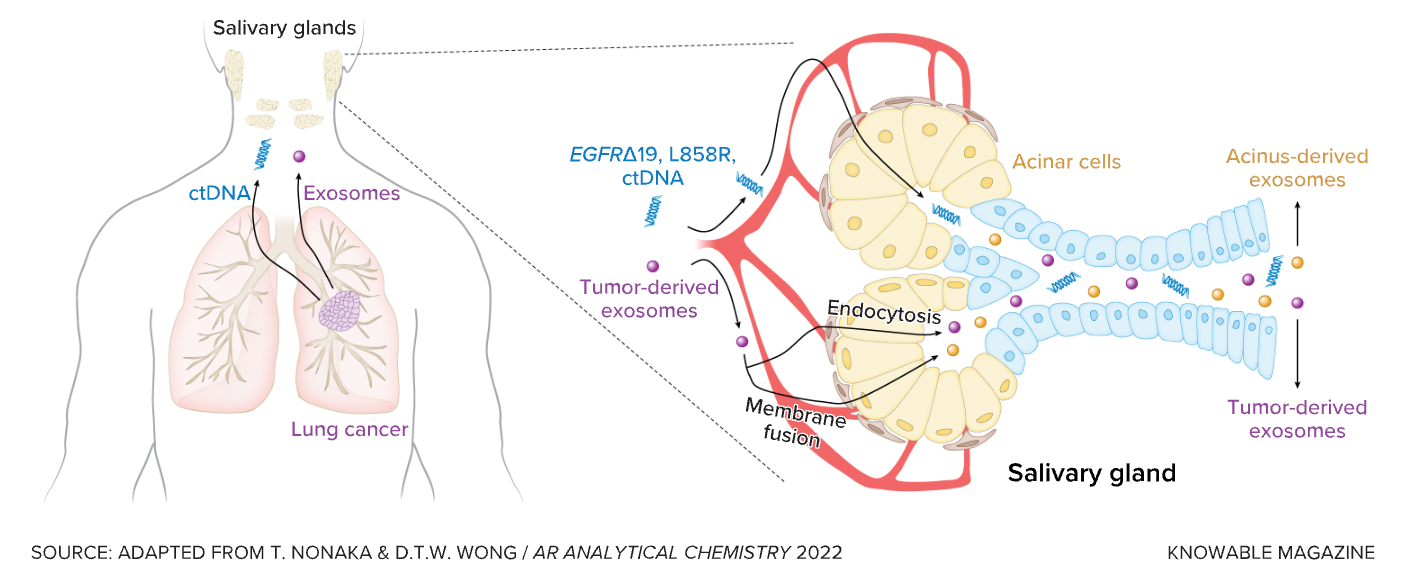
图. 唾液中含有的信号或可为非小细胞肺癌提供警报。
一个普通成年人的唾液腺平均每天产生500至1500 mL的唾液,以帮助消化和维护口腔健康。除了酶、激素、抗体、炎症介质、食物残渣和微生物之外,唾液中还含有来自肿瘤的微量的DNA和RNA或蛋白质。
路易斯安那州立大学的牙科科学家Taichiro Nonaka和加州大学洛杉矶分校的David T.W. Wong在2022年发表于Annual Review of Analytical Chemistry杂志的一篇关于唾液诊断5的文章中写道,“唾液诊断的目标是开发快速、无创的口腔和全身疾病检测方法。”
由于“组学科学”的进步,该领域正在迅速发展。组学分析涉及大量与生物体功能有关的分子,如基因组学(基因组)、蛋白质组学(蛋白质)或代谢组学(代谢物),以及多种数据分析的方法。例如,唾液的蛋白质组——存在于这种液体中蛋白质集合——已经可以获得,而且已知有20%到30%唾液蛋白质与血液中的蛋白质存在交叉。
但是“通过唾液进行诊断是一个相对较新的领域。”Nonaka说道。他说,直到最近十年,人们才知道唾液腺(包括腮腺、下颌下腺和舌下腺,以及其他靠近血管的小腺体)也会传递分子信息。
现在,科学家们开始在唾液和血液中挖掘循环肿瘤DNA(ctDNA),一种由癌细胞脱落的DNA。许多研究都找到了生物标志物,如在癌细胞中产生较多的蛋白质或在肿瘤细胞中发生的遗传变化。这些生物标志物可用于检测头颈部6、胸部7、食道8、肺9、胰腺10和卵巢11的肿瘤,以及监测患者对治疗的反应。
例如,2015年,中国研究人员发表文章称12,通过鉴定唾液中的microRNA的两个片段,可以从10名患有胰腺癌的患者中检测出7名患有恶性胰腺癌。最近对纳入8000多名参与者、涉及14项研究进行分析的综述13估计,乳腺癌患者的唾液中具有某些可检测的生物标志物的可能性是其他人的2.58倍——尽管39%的阴性检测结果来自实际患有乳腺癌的患者。Nonaka说,该领域的研究很有希望,但需要进一步的前瞻性研究来确定其临床适用性。
“液体活检的一大优势在于,它们可以在早期阶段一次扫描多达50种癌症,而在这一阶段,人们可以通过手术或者短期定向治疗来消灭癌症14。”生物学家Marina Simián说,他是位于布宜诺斯艾利斯的阿根廷圣马丁国立大学纳米系统研究所国家科学技术研究委员会的研究员。Simián还是Oncoliq公司的联合创始人,该公司旨在通过血液样本在早期检测乳腺癌、前列腺癌和其他肿瘤。
“利用现有的工具,只能对部分器官进行癌症筛查。”Simián说。常见的癌症筛查包括对前列腺、乳房、宫颈、结肠(50岁以上)进行筛查,以及对重度吸烟者进行的肺部筛查。她表示,全世界只有半数的人接受了这些测试,在许多国家,这一数据甚至不到10%。他们希望增加更多对血液或唾液样本进行的测试。
未来,血液和唾液检测可能会成为常态。虽然还有很长的路要走,但Nonaka相信,除了口腔癌,唾液检测很可能需要辅血液或尿液检测,并再加上其他参数,以提高检测的灵敏度和效用。
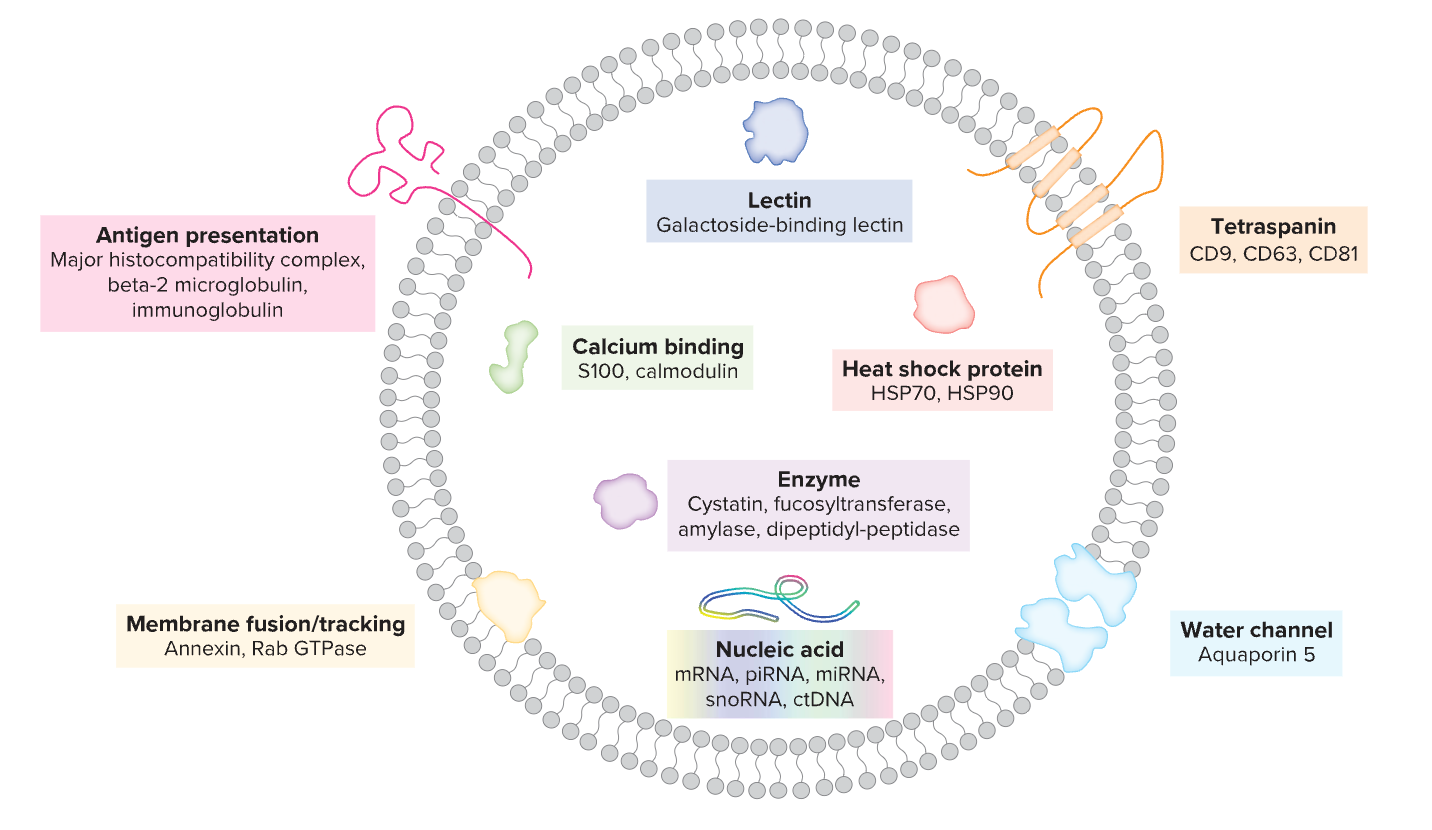
图. 唾液中的外泌体含有不同的内容物。
唾液中能找到的一种特别有前景的成分是外泌体15。它是由脂质包裹的一种微小囊泡,存在于几乎所有类型的体液中。它们是转运工具或信使,从一个细胞到另一个细胞,甚至是到那些远端的身体器官中。
外泌体携带大量的遗传物质和蛋白质,这些物质被受体细胞所吸收,并在细胞间信号传递过程中发挥重要作用。外泌体在癌症中也具有重要作用。“它们很关键。”Punyadeera说。癌细胞也会释放外泌体。然后这些外泌体会进入血液,然后到达唾液腺。因此,可以从唾液中收集到它们。
来自肿瘤细胞的外泌体具有特定的成分,被怀疑有助于癌症向其他器官或组织的扩散。但从诊断的角度来看,它们的主要优势之一是可以包装和保护运输物品——换句话说,它们不会与唾液的其他成分混合。Nonaka解释说,通过这种方式,它们为疾病检测提供了“更稳定和准确的临床相关信息”。
例如,对于鳞状细胞食管癌,科学家们在唾液外泌体中发现了两个信号分子,除了为预后和治疗提供指导外,还可以用于检测该疾病,其敏感性和特异性超过90%16,这一研究结果于2022年1月在Molecular Cancer上发表。
显微镜下外泌体的浓度或外观等因素也可以帮助我们揭示问题。例如,口腔癌患者外泌体的形状和大小与健康人不同17。
然而,迄今为止可用来分离和研究唾液中外泌体的技术既昂贵又费力。为了应对这一挑战,出现了一种名为电场诱导的释放与检测,即EFIRM的新方法18:它集成了电化学传感器和磁场,可以轻松捕获微量的ctDNA和分子(生物标志物),从而指示癌症的存在。该技术已经在非小细胞肺癌的早期检测19中显示出令人振奋的结果,也可用于评估对治疗的反应。
Wong持股的美国公司Liquid Diagnostic已经开始提供这项技术,并将其命名为“Amperial”,同时承诺该方法“对早期癌症具有高特异性和敏感性”,而且“成本要低得多”。
那些热衷于这项技术的人们设想了这样一种未来:只要定期去看牙医就能挽救生命,而且不需要抽血来检查病人是否生病。但专家们一致认为,要让这一梦想变为现实,仍需进一步研究。
“为了实现唾液生物标志物在临床上的应用,一方面需要制定标准化协议,另一方面有必要开展大型多中心研究,分析年龄、性别或生活方式等不同混杂变量的影响。”西班牙圣地亚哥德孔波斯特拉健康研究所的牙科科学家Óscar Rapado González说道,他正在研究使用唾液样本检测头颈癌症和肠癌。
Rapado González说,除了早期检测外,在唾液或其他液体中识别与肿瘤直接或间接相关的分子还有其他应用潜力。它可能可以用于评估个体罹患癌症的风险、预测肿瘤如何发展,或是使以非侵入性的方式监测癌症治疗反应成为可能,也能使个性化药物的开发成为可能。
Rapado González表示:“毫无疑问,有关该领域的更多研究将在未来几年有力推动唾液在精准肿瘤学中的应用发展。”
参考文献:
(滑动查看下文)
1. Bull H, Murray PG, Thomas D, et al. Acid phosphatases[J]. Molecular Pathology, 2002, 55(2):65-72. DOI: 10.1136/mp.55.2.65.
2. Hoerman KC, Chauncey HH, Herrold RD, et al. Parotid saliva acid phosphatase in prostatic cancer[J]. Cancer, 1959, 12(2):359-363.
3. Lin AA, Nimgaonkar V, Issadore D, et al. Extracellular vesicle-based multianalyte liquid biopsy as a diagnostic for cancer[J]. Annual Review of Biomedical Data Science, 2022, 5:269-292.
4. Banavar G, Ogundijo O, Toma R, et al. The salivary metatranscriptome as an accurate diagnostic indicator of oral cancer[J]. npj Genomic Medicine, 2021, 6:105. DOI: 10.1038/s41525-021-00257-x
5. Nonaka T, Wong DTW. Saliva diagnostics[J]. Annual Review of Analytical Chemistry, 2022, 15:107-121.
6. Wang Y, Springer S, Mulvey CL, et al. Detection of somatic mutations and HPV in the saliva and plasma of patients with head and neck squamous cell carcinomas[J]. Science Translational Medicine, 2015, 7(293):293ra104-293ra104.
7. Zhang L, Xiao H, Karlan S, et al. Discovery and preclinical validation of salivary transcriptomic and proteomic biomarkers for the non-invasive detection of breast cancer[J]. PLoS ONE, 2010, 5(12):e15573.
8. Du J, Zhang L. Analysis of salivary microRNA expression profiles and identification of novel biomarkers in esophageal cancer[J]. Oncology Letters, 2017, 14(2):1387-1394.
9. Zhang L, Xiao H, Zhou H, et al. Development of transcriptomic biomarker signature in human saliva to detect lung cancer[J]. Cellular and Molecular Life Sciences, 2012, 69:3341-3350.
10. Zhang L, Farrell JJ, Zhou H, et al. Salivary transcriptomic biomarkers for detection of resectable pancreatic cancer[J]. Gastroenterology, 2010, 138(3):949-957. e7.
11. Lee YH, Kim JH, Zhou H, et al. Salivary transcriptomic biomarkers for detection of ovarian cancer: for serous papillary adenocarcinoma[J]. Journal of Molecular Medicine, 2012, 90:427-434.
12. Xie ZJ, Yin XY, Gong B, et al. Salivary microRNAs show potential as a noninvasive biomarker for detecting resectable pancreatic cancer[J]. Cancer Prevention Research, 2015, 8(2):165-173.
13. Koopaie M, Kolahdooz S, Fatahzadeh M, et al. Salivary biomarkers in breast cancer diagnosis: A systematic review and diagnostic meta‐analysis[J]. Cancer Medicine, 2022, 11(13):2644-2661.
14. Lin AA, Nimgaonkar V, Issadore D, et al. Extracellular vesicle–based multianalyte liquid biopsy as a diagnostic for cancer[J]. Annual Review of Biomedical Data Science, 2022, 5:269-292.
15. Pegtel DM, Gould SJ. Exosomes[J]. Annual Review of Biochemistry, 2019, 88:487-514.
16. Li K, Lin YS, Luo YC, et al. A signature of saliva-derived exosomal small RNAs as predicting biomarker for esophageal carcinoma: a multicenter prospective study[J]. Molecular Cancer, 2022, 21:21.
17. Sharma S, Gillespie BM, Palanisamy V, et al. Quantitative nanostructural and single-molecule force spectroscopy biomolecular analysis of human-saliva-derived exosomes[J]. Langmuir, 2011, 27(23):14394-14400.
18. Tu M, Cheng J, Chen YL, et al. Electric field–induced release and measurement (efirm): characterization and technical validation of a novel liquid biopsy platform in plasma and saliva[J]. The Journal of Molecular Diagnostics, 2020, 22(8):1050-1062.
19. Li F, Wei F, Huang WL, et al. Ultra-short circulating tumor DNA (usctDNA) in plasma and saliva of non-small cell lung cancer (NSCLC) patients[J]. Cancers, 2020, 12(8):2041.


