当前,微生物组疗法领域可谓冰火两重天。一些公司迎喜讯,如Ferring Pharmaceuticals公司旗下的Rebyota产品成为首个获得FDA批准的微生物组疗法,而另一些公司则宣布终止试验甚至面临破产,如Finch Therapeutics取消3期试验并裁员95%。那么,当前微生物组疗法的发展都面临着哪些挑战?
今天,我们共同关注微生物组疗法。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
在过去的十年里,探索肠道的想法引起了投资者和公众的极大兴趣,但近年来的研究表明,在这种治疗方法成为主流之前,还有很多工作要做。 而且,由于FDA对微生物组疗法的安全性持严格的态度——这在临床中得到了体现,很大程度上导致了最近一段时间人们对该领域的热情有所减弱。
Finch Therapeutics公司针对复发性艰难梭菌感染(CDI)的III期PRISM4试验和MaaT Pharma公司针对类固醇难治性急性移植物抗宿主病的III期临床试验均被搁置。虽然法国微生态制药公司MaaT Pharma已向FDA提交了更多的补充信息,但其临床试验仍处于搁置状态。2023年1月,Finch公司宣布将彻底取消PRISM4试验。
这些疗法的原理是通过利用捐赠者粪便样本中的细菌,来改变肠道微生物组。2022年11月,Ferring Pharmaceuticals公司的Rebyota成为首个获得FDA批准的微生物组疗法,用于治疗复发性CDI。但该疗法是在举行FDA咨询委员会会议后才得以获批。
此外,COVID-19大流行使微生物组疗法成为人们关注的焦点,因为这类药物存在潜在的传播风险。
“整个领域都受到了新冠疫情的影响。我们损失了三年时间。”多伦多大学健康网络传染病专家Susy Hota博士说。
与此同时,生物技术市场的严峻环境影响了一些公司。2月16日,专注于微生物组疗法的生物技术公司4D Pharma在2022年6月进入接管程序(破产程序的一个环节)后,从伦敦证券交易所退市。在Finch公司决定结束PRISM4项目的同时,它还宣布了将裁员95%。早在2022年4月,专注于微生物组的生物技术公司Kaleido Therapeutics就因财务和监管方面的挫折而倒闭。
Hota说,虽然大约五年前有很多关于微生物组的炒作,但现在是否仍然如此,是一个问题。此外,微生物组疗法需要在其他适应症中发挥作用,才能持续引起人们的兴趣。Hota说:“如果复发性CDI是主要的适应症,那么对很多人来说,这并不是一个非常有吸引力的领域。”

Hota说,总的来说,微生物组研究并没有像预期的那样发展,部分原因是安全问题。尽管新冠疫情打乱了各种研究的进度,但依靠粪便样本进行的研究尤其受到影响。
这些安全问题的核心是不同疾病所带来的感染风险,如COVID-19和猴痘。2020年3月,因为COVID-19,FDA发布了一份关于粪菌移植(FMTs)的安全警报。该文件要求在捐赠者筛查方案中增加对COVID-19感染者的识别。
两年多后,FDA发布了类似的警告,要求在进行FMT时进行更多的筛查,以规避猴痘病毒风险。
北卡罗来纳大学教堂山分校医学院的医学副教授Sarah McGill博士说,这些安全问题阻碍了研究。尽管至今为止她不曾听闻过因FMT感染COVID-19的案例。
不过,Hota指出,最好的办法是对每个样本进行筛查,但这引起了对FMT可持续性的质疑。
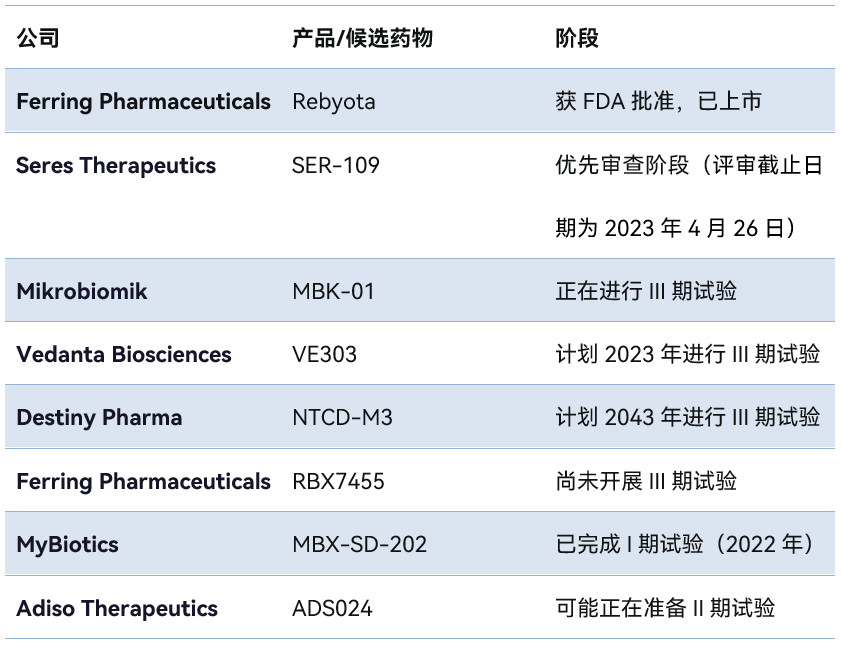
表. 用于治疗艰难梭菌感染CDI的微生物组疗法(部分)
加州大学圣地亚哥分校斯克里普斯海洋研究所的儿科教授Jack Gilbert说,目前,该行业正处于“荒野西部” 阶段。Gilbert说,虽然这方面的研究已经有20年的历史了,但与基因组学等其他领域相比,它仍然是一个新兴领域。
费城宾夕法尼亚大学临床医学副教授Neilanjan Nandi博士说,在某种程度上,FMT在CDI中的使用为微生物组疗法铺平了道路。Gilbert说,虽然Rebyota是第一个被批准的疗法,但他相信很快就会有更多的项目获批。
Rebyota是一种基于粪便微生物组的治疗方法,用灌肠的方式来治疗复发性CDI。在III期PUNCH CD3试验中,Rebyota在降低CDI复发方面的效果优于安慰剂:8周时,Rebyota治疗的成功率为70.6%,而安慰剂为57.5%。
Seres Therapeutics公司的SER-109正在接受优先审查,FDA将其用于治疗复发性CDI适应症的PDUFA date(评审截止日期)设定为2023年4月26日。与Rebyota不同的是,SER-109采用胶囊形式,并需持续服用三天。
此外,Puretech Health公司的子公司——Vedanta Bioscience公司计划在今年开展VE303治疗CDI的III期临床试验。与Rebyota和SER-109不同,Vedanta的治疗方法不依赖于捐赠者的粪便样本,而是使用已经被分离出来的菌株。另一家名为Destiny Pharma公司则计划在明年开展其用于CDI治疗的候选药物NTCD-M3的III期试验。
Nandi说,CDI应该被视为只是一个开始,炎症性肠病(IBD)也是一个有趣的方向。
然而,Hota和McGill说,这里的结果相当复杂。例如,在治疗溃疡性结肠炎的IIb期研究中,与安慰剂相比,Seres公司的SER-287并没有达到临床缓解的主要终点。SER-109和SER-287都是由来自粪便样本并经纯化的厚壁菌门孢子组成的。根据Seres公司的官网,该生物技术公司正在进行研究,以决定溃疡性结肠炎项目的未来,其中还涉及另一个名为SER-301的候选药物。
去年,武田制药在对其管道进行审查后,于8月终止了与Finch公司的交易。此前,武田曾与Finch公司达成合作,共同开发用于IBD治疗的候选药物FIN-524和FIN-525。
尽管如此,其他公司仍热衷于进一步探索IBD,比如总部位于英国的Microbiotica公司。这家初创公司预计将于今年开始溃疡性结肠炎的Ib期研究,并专注于开发口服多菌株疗法。
微生物组疗法在癌症领域的潜在应用也面临着一些问题。Hota说,虽然人类在日常活动中通常会遇到微生物,但正常情况下,我们的免疫系统可以处理这些微生物。然而,癌症患者的免疫力会受到化疗等治疗的抑制,因此风险要大得多。
马里兰州切维切斯临床研究中心的联合主任Louis Korman博士说,微生物组疗法可以用作癌症的辅助治疗,但不是主要治疗。Korman说,很多免疫疗法会对胃肠道产生副作用。他解释说,考虑到这一点,微生物组疗法可以用来减少副作用。
McGill说,尽管人们对微生物组疗法的热情普遍很高,但在专家会议上,这种热情目前有所减弱。Gilbert表示,由于该领域的广泛性,投资者会存在一些困惑。他补充称,生物技术市场的现状进一步强调了这一点。
但McGill指出,随着首个产品得到批准,这种情况可能会发生变化。她表示,在某种程度上,这种可及性会增加人们的热情和兴趣。


