后生元等于死菌吗?还是指微生物的有益产物?当前后生元的研究和市场发展趋势如何?不同国家的监管情况又是怎样的?
今天,我们共同关注后生元市场。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
2013年Tsilingiri K等人首次提出后生元的概念,指出其是指益生菌代谢活动释放的,并且能够以直接或间接的方式对宿主产生有益影响的因子。
2018年Aguilar-Toalá J. E.等人就后生元的定义提出了新看法,指出其是由活细菌分泌或细菌溶解后释放的可溶性因子(产物或代谢副产物),如酶、肽、磷壁酸、肽聚糖衍生的胞壁肽、多糖、细胞表面蛋白质和有机酸。2019年,Aguilar-Toalá J. E又更新了定义,指出益生菌产生的对宿主具有生物效应的非活性代谢物是后生元。
以上三个定义的共性是均不包含微生物细胞。后续,不同研究者又先后重新定义了后生元的概念。
Collado M. C.等人认为后生元是指由微生物产生的,从食物成分或微生物成分中释放的化合物,包括不可存活的细胞,当剂量足够时,可促进健康。Johnson C. N.则认为益生菌微生物产生的对宿主或微生物群有积极影响的非活性细菌产品或代谢副产品可以被称为后生元。Wegh C. A. M.等人提出后生元是指发酵过程中基质中产生的可用于促进健康的功能性生物活性化合物。
直到2021年,国际益生菌和益生元科学协会(ISAPP)召集了专家小组,对后生元的定义和范围进行了审议,并以共识声明的形式在Nature Reviews Gastroenterology and Hepatology杂志上发表,指出后生元是对宿主健康有益的无生命微生物和/或其成分的制剂。
根据这一定义,有效的后生元无论是否含有细菌代谢物,都必须含有灭活的微生物细胞或细胞成分,且能够观察到健康益处。同时需满足以下条件才能称为合格的后生元制剂:
a)明确前体微生物的分子特征,以便准确识别和筛选潜在的安全相关基因;
b)具有灭活程序和基质的详细说明;
c)确认微生物已灭活;
d)具有由高质量的对照试验提供的对宿主健康有益的证据;
e)具有后生元制剂成分的详细说明;
f)具有后生元制剂在目标宿主中预期用途的安全性评估。
不过ISAPP发表的这一共识引起了较大的争议。中国农业科学院饲料研究所周志刚等38位科学家专门致信Nature Reviews Gastroenterology and Hepatology杂志,对这一后生元定义提出了不同的看法,其中明确指出后生元最初的定义是指对宿主具有明显益处的单一/混合物质,即认为后生元必须要包括菌体这一要求不妥。
因此,当前关于“后生元”的定义仍存争议,未来可能还需要根据已有的定义以及后生元的科学研究和应用情况,对其定义进行优化。考虑到这一背景,在本文中我们将采用更广义的定义,即将不包括菌体的微生物产物视为后生元。
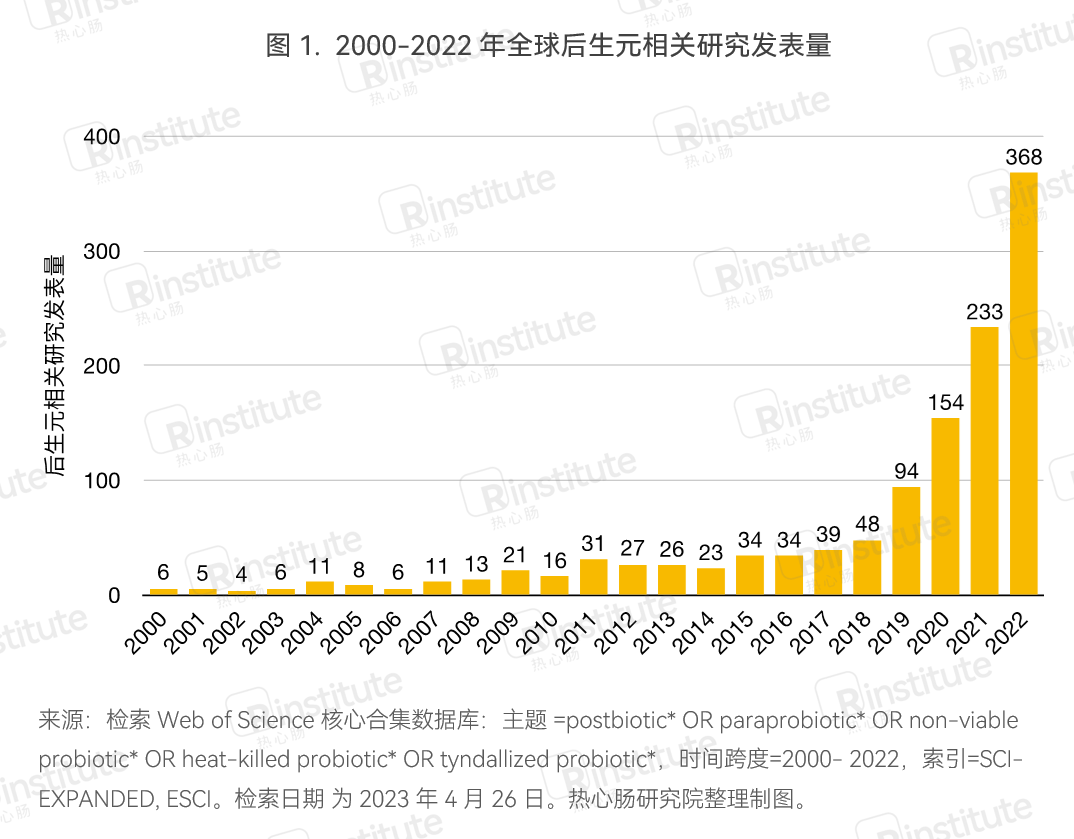
Web of Science数据库的数据显示(图1),自2018年起,后生元研究快速增长,2022年总发表量达到了368篇,相比2021年增幅达到57.9%。2022年的后生元研究主要聚焦于炎症性肠病、感染、口腔健康、特应性皮炎、痤疮、过敏等健康问题,同时也涉及了乳品与动物科学、食品科学与技术、作物科学等方向。2022年,中国共发表超过50篇后生元的研究,意大利紧跟其后位居第二,美国、韩国、伊朗则位列第三到第五名。
不过因为后生元领域处于起步期,关于后生元的定义仍存争议,表述也尚未完全统一,因此上述数据难以纳入所有后生元文章,但仍可体现出后生元领域发展的整体趋势。
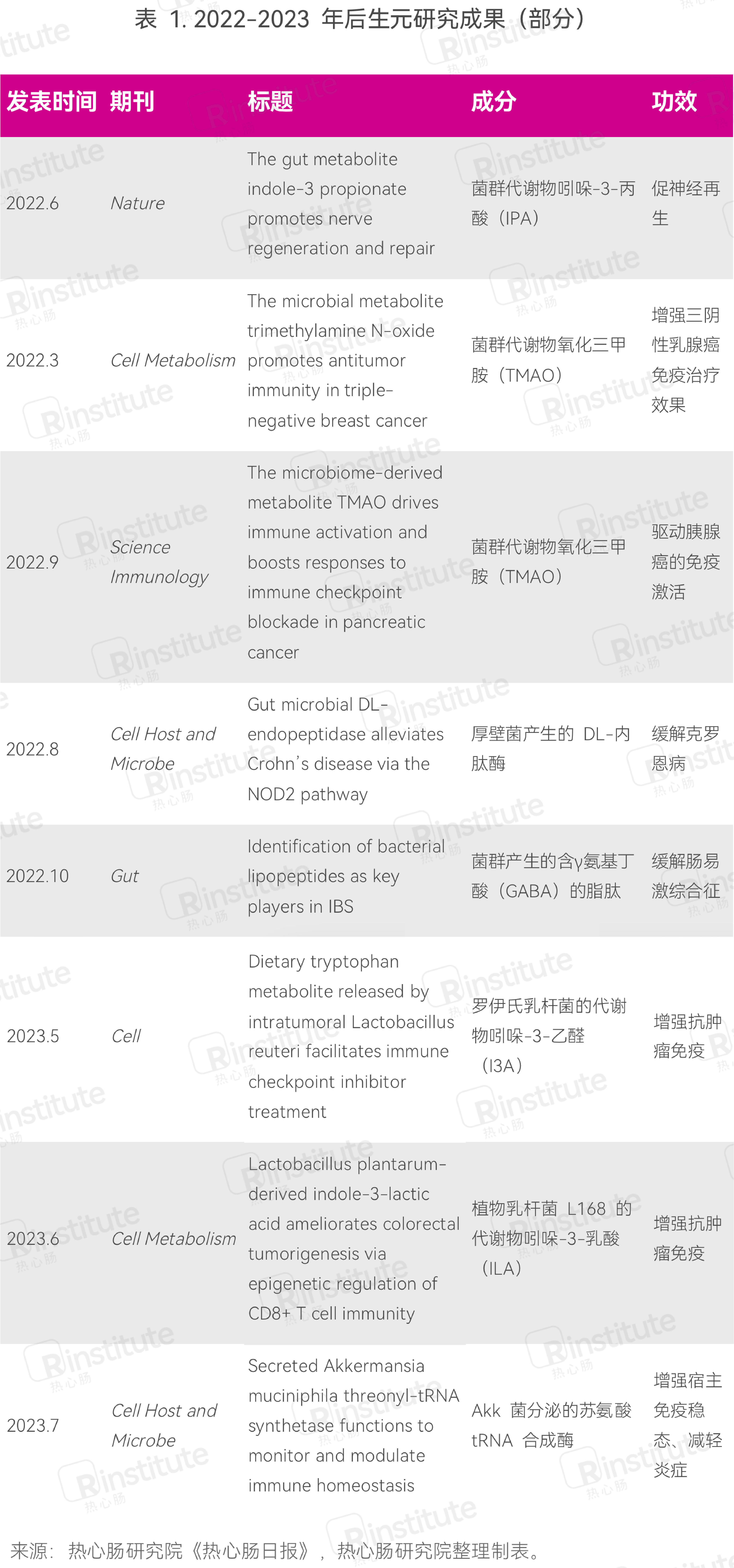
具体地,2022年有多篇后生元文章发表在Nature、Science、Cell及其子刊上(表1),反映出后生元研究领域不仅在文章发表数量上不断前进,在质量上也是不断进步,并已经成为前沿科学的焦点之一。在具体的研究物质方面,一方面研究人员继续聚焦于微生物的代谢物,如吲哚-3-丙酸(IPA)、氧化三甲胺(TMAO),另一方面开始探索代谢物以外的微生物成分,如酶等。
2023年后生元领域继续高歌猛进,在顶尖期刊上发表了一系列高水平文章(表1)。热心肠研究院《热心肠日报》的数据显示,发表在高水平杂志上的后生元文章主要聚焦于免疫,重点针对辅助抗癌、缓解肠道炎症等。
根据英敏特统计的社交媒体数据,2018-2019年后生元是热度增长最猛的微生态成分。数据显示,后生元增长率为91%,益生元为83%,益生菌为41%。由此可见,消费者对后生元的兴趣日益增长。
与益生菌相比,后生元具有多种优势,比如其无需保持活性,因此对生产、储存等条件要求较低,同时应用场景也更加广阔。近年来,随着后生元研究的不断深入,越来越多的企业已经开始关注到这一领域,许多膳食补充剂行业龙头都先后布局(图2)。

2023年2月,ADM宣布其位于西班牙瓦伦西亚的益生菌生产工厂正式开业,该工厂将同时生产益生菌与后生元(动物双歧杆菌BPL1灭活版本)。同年4月,帝斯曼(DSM)公司宣布与后生元企业Adare Pharma Solutions进行独家谈判,拟以2.75亿欧元(约合人民币20.76亿元)的价格收购后者,7月Dsm-firmenich(2023年6月DSM与Firmenich合并为Dsm-firmenich)宣布已成功完成收购。
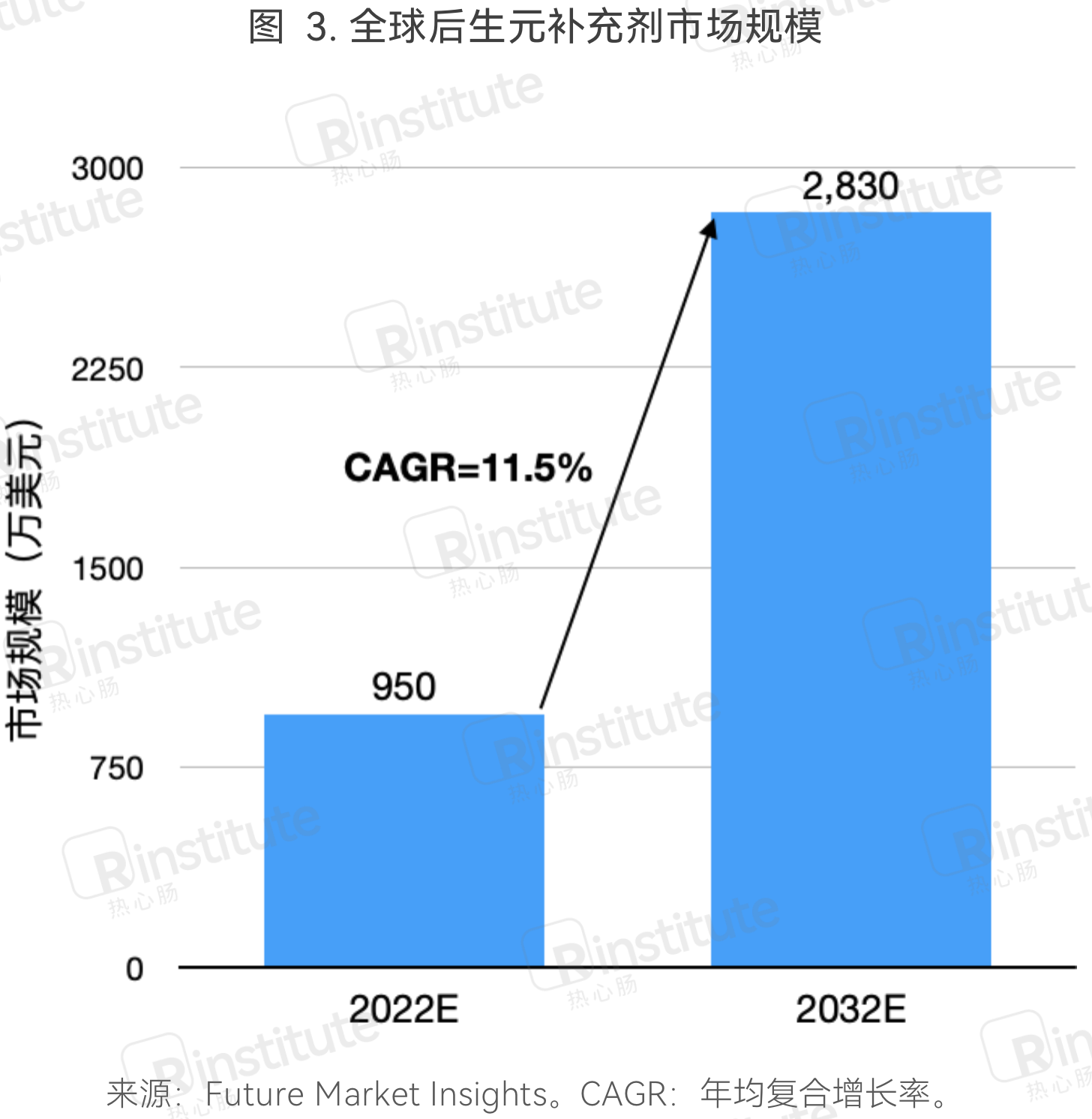
根据Future Market Insights的数据, 2022年全球后生元补充剂市场达到950万美元(估计值)。随着人们对后生元的认知不断升高,该市场的年均复合增长率有望从2016-2021年的7.6%提高到2022-2032年的11.5%,预计到2032年达到2830万美元。
后生元行业起步较晚,当前监管尚处于起步期,相关空白较大。目前应用于市场的后生元大多为灭活益生菌,因此主要参考微生物相关法规标准。各国针对后生元的监管措施如下:
1. 中国:对可用于食品的菌种以“名单制”进行管理,用于制备后生元的微生物来源参考国家卫生行政部门发布的可用于食品的菌种(株)。GB/T32099-2015《酵母产品分类导则》与 GB/T20886.1-2021《酵母产品质量要求第1部分:食品加工用酵母》中提出“非活性食用酵母”这一概念,但从定义看并不包括发酵产物。此外值得一提的是,2023年2月21日,国内首个《益生菌制品 乳酸菌类 后生元》团体标准发布。该标准的发布不仅弥补了国内后生元产业发展无标可依的空白,同时大力推动了我国后生元产业高质量发展。
2. 美国:美国食品药品管理局(FDA)通过GRAS管理食品用菌种及食品添加剂等成分,采用“企业自我认可,FDA 备案制度”评价物质的安全性并形成GRAS清单。目前FDA对灭活菌种在食品中的应用可通过申报 GRAS的形式对产品进行备案。
3. 加拿大:在加拿大司法部发布的《天然健康食品条例(Natural Health Product Regulations (NHPR)SOR/2003-196)》中,细菌、真菌及其分子结构未改变的提取物或分离物均可视为“天然健康食品”(NHP)。基于此,部分灭活微生物产品可向加拿大卫生部提交申请作为天然健康食品,由卫生部审查产品成分及健康作用。
4. 欧盟:欧盟食品安全局通过QPS程序评估食品用菌种的安全性,可适用于评估制备后生元的微生物。若使用未列入QPS名单的微生物生产食品,需根据欧盟新资源食品管理条例 Regulation(EU)2015/2283相关要求申报新资源食品审批。
5. 日本:可通过3种监管渠道申请对食品的健康声称,分别是特定健康用途食品(FOSHU)、具有营养功能声明的食品(FNFC)和具有功能声称的食品(FFC)。目前没有含灭活微生物的相关产品获批FOSHU。FFC无需审批,但需在上市前60天向消费者厅提交其安全性、功效性评价与科学依据、生产与质量管理方法等必要材料,政府不提供许可标签。目前仅有少数灭活乳酸菌产品申报获得了FFC许可。
6. 澳新:澳大利亚新西兰食品标准局(FSANZ)和澳大利亚卫生部尚未颁布后生元相关的标准法规。根据《食品标准法典》中的“营养、健康及其相关声称”规定,若食品需申报健康声称,企业需自主开展系统性审查以证实食品和健康声称之间的关系,并将评估结果告知澳大利亚政府。
随着后生元行业的快速发展,相信后生元市场的监督管理将会日益成熟规范,相关机构将会出台针对后生元的监管办法,而这将进一步推动全球后生元市场蓬勃发展。


