2022年发表一系列研究凸显出几种新型药物在治疗炎症性肠病(IBD)上的效力。为了确定IBD疗法的先后顺序,还有研究者进行了头对头试验(非安慰剂对照的实验)和网络荟萃分析,但要真正实现个性化医疗,我们仍有很长的路要走。
今天,我们特别编译发表在Nature Reviews Gastroenterology & Hepatology杂志上关于IBD的年度回顾文章。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
关键要点
1. IL-23p19抗体古塞库单抗(guselkumab)和瑞莎珠单抗(risankizumab)的临床试验表明,其对于诱导和维持中度至重度活动性克罗恩病的缓解是安全有效的。
2. 一项对JAK抑制剂乌帕替尼(upadacitinib)开展的III期试验表明,对既往接受过或未接受过生物治疗的中度至重度活动性溃疡性结肠炎患者来说,upadacitinib是有效的。
3. 口服整合素α4抑制剂carotegrast methyl(AJM300)的III期试验证明其在轻中度活动性溃疡性结肠炎中可作为有效的诱导疗法;该药物现已在日本获批用于临床。
4. 在头对头SEAVUE试验中,阿达木单抗(adalimumab)和乌司奴单抗(ustekinumab)对中度至重度活动性克罗恩病的的疗效相似。
炎症性肠病(IBD)是一种免疫介导的慢性消化道炎症性疾病,包括克罗恩病和溃疡性结肠炎。有证据表明,其发病机制与遗传易感性和(或)环境诱因导致的免疫失衡密切相关。这种认识推动了新疗法的发展,但这些疗法的使用策略尚未建立。
肿瘤坏死因子(TNF)抗体英夫利昔单抗(infliximab)的引入是该领域的一项重大突破,因为它可以诱导和维持缓解,并且效果好于传统治疗方案(如5-氨基水杨酸和皮质类固醇)。随后,各种免疫调节疗法被开发出来,包括多种TNF抗体和IL-12/IL-23p40抗体。Janus激酶(JAK)抑制剂和鞘氨醇-1-磷酸(S1P)受体调节剂也已被证明是有效的。
这些疗法已被引入临床实践,但仍有几个问题未得到解决,如:缓解率仅为20-30%,相当一部分患者出现继发性反应丧失,一些患者仍需要皮质类固醇的治疗,安全性问题尚未完全解决等。然而,2022年新疗法的出现可能会给IBD的治疗带来新的突破。

首先,基于IL-23p19抗体瑞莎珠单抗(risankizumab)在III期临床试验ADVANCE和MOTIVATE两项研究中表现出的对中重度活动性克罗恩病的良好疗效,risankizumab被引入了临床实践之中1。静脉注射risankizumab在临床缓解和内镜缓解这两个共同主要终点上达到了统计学意义上的显著改善。
Risankizumab维持1年缓解的疗效在III期FORTIFY研究中也得到证实2。并且,对初次使用生物制剂治疗的患者和先前已接受过生物制剂治疗的患者来说,risankizumab的疗效是相同的。
另一种IL-23p19抗体古塞库单抗(guselkumab)对克罗恩病的疗效在II期GALAXI-1试验中也得到了证实3。IL-23p19的另一种单克隆抗体米吉珠单抗(mirikizumab)也成功用于治疗中重度活动性溃疡性结肠炎患者——其III期试验已经完成4,监管机构正在考虑mirikizumab的临床批准。
单克隆抗体疗法需要静脉注射,在过去3年,由于COVID-19大流行的阻碍,许多会诊转移到远程医疗平台,口服治疗的便利性也得以凸显。2022年,新型JAK抑制剂出现,为患者提供了每日一次口服治疗的友好选择。
在2021年发表了非戈替尼(filgotinib)的阳性试验结果之后,2022年,乌帕替尼(upadacitinib)治疗溃疡性结肠炎的III期试验结果正式发表5。在这项研究中,两个队列接受了45mg upadacitinib的诱导治疗,每天1次,持续8周。与安慰剂相比,该治疗显著提高了获得缓解的患者比例(在两个队列中分别为26% vs 5%和36% vs 4%)。
但是,正如第一代JAK抑制剂托法替尼(tofacitinib)所报道的那样,该疗法与带状疱疹病毒感染风险增加有关。
此外,对乌司奴单抗(ustekinumab)诱导治疗有反应的患者继续接受30mg或15mg的upadacitinib或安慰剂,维持治疗52周,与安慰剂相比,这两种剂量都增加了获得临床缓解的患者比例。
除JAK抑制剂外,其他口服小分子药物也正在被开发用于IBD的治疗,包括口服抗整合素药物。2022年,整合素α4抑制剂carotegrast methyl(AJM300)的III期试验结果证明了其在轻中度活动性溃疡性结肠炎中作为诱导疗法的效果。在第8周,接受AJM300治疗组达到临床缓解的比例(45%)显著高于安慰剂组(21%)。在这些结果的基础上,AJM300已在日本被批准用于临床6。
AJM300在试验中的安全性良好,但还需要在实际使用中继续确认该疗法是否会增加进行性多灶性白质脑病的风险,进行性多灶性白质脑病是整合素α4抗体那他珠单抗(natalizumab)的严重不良反应。
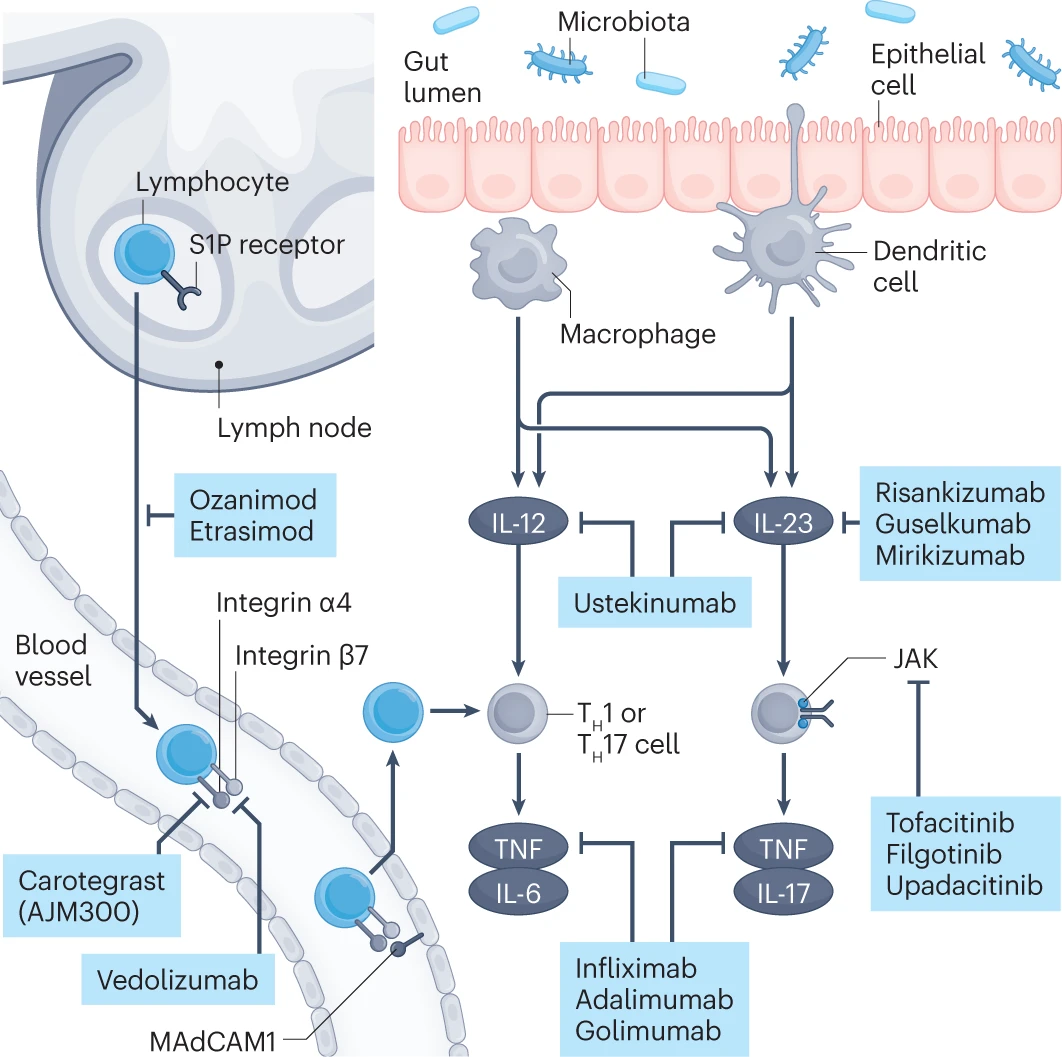
图. 免疫调节药物在炎症性肠病中的作用机制 注:药品用蓝色的方框显示。JAK,Janus激酶;S1P,鞘氨醇-1-磷酸;TH cell,T辅助细胞;TNF,肿瘤坏死因子。
这些新的治疗方案的出现意味着我们有大量可用的并具有不同作用机制的IBD疗法,因此讨论这些疗法的使用顺序是必要的。我们不能轻易地根据不同疗法的作用机制轻易确定它们的合理使用方法。
在大多数新疗法的试验中都纳入了亚组分析,以比较以前接受过和没有接受过生物制剂治疗的患者的疗效。这些分析表明,对于先前接受抗TNF治疗的溃疡性结肠炎患者,ustekinumab和tofacitinib可能是有利的选择。
然而,这些数据还不足以得出什么时候使用哪种治疗方法的确切结论,目前已经进行了头对头的研究,以更直接地比较疗效。
CYSIF研究比较了infliximab和环孢素治疗严重活动性溃疡性结肠炎的疗效,结果表明,两种药物的疗效相同。在VARSITY研究中,研究者比较了维多珠单抗(vedolizumab)和阿达木单抗(adalimumab)治疗中重度活动性溃疡性结肠炎的疗效和安全性,结果显示在第52周时,就达到临床缓解和内镜改善方面,vedolizumab更具优势7。
2022年,发表了一项新的头对头研究——SEAVUE研究,该研究证明ustekinumab和adalimumab治疗克罗恩病的效果相似8。有趣的是,这两种抗体不仅在第52周时临床缓解这一主要终点效果相似,而且起效速度也相似。
除了这些头对头研究外,研究者还使用网络荟萃分析进行了多项间接比较。2022年发表的一项网络荟萃分析表明,无论是在患者之前是否接受过生物治疗,upadacitinib均优于所有其他治疗溃疡性结肠炎的生物疗法9。在另一项类似的分析中,infliximab和risankizumab在治疗克罗恩病方面排名最靠前10。
不管这些研究的结果如何,这样的比较是否是制定个体化治疗方案合适的基础是值得怀疑的。即使我们在开始治疗时选择了在头对头研究中更好的选择,患者仍有很大可能无法达到缓解。在这种情况下,我们需要尝试二线疗法,然后也可能用到三线疗法。
我们拥有的选择越多,在为每个患者确定最合适的治疗方法时,我们就越有可能“绕路”。在这种情况下,需要明确可以预测每种疗法结果的因素,以使其在真实世界中得到适当的使用和选择。
例如,一些证据表明,检测抑瘤素M(OSM)表达和HLA-DQ5基因分型可以帮助我们预测TNF抗体治疗的结果,但仍需要在大型临床研究中进行证实,而且这些发现是否适用于其他治疗尚不清楚。
尽管在分子水平上对IBD进行了大量的研究,但我们缺乏证据来确定如何在正确的时间对正确的患者进行正确的治疗。此外,对于几种治疗方案,其长期使用的安全性尚未确定。新疗法能否改善患者的生活,取决于我们能在多大程度上开发和建立适当的个体化治疗方法。为了促进这一进程,需要进行公正、公平和高质量的临床研究。
参考文献:
(滑动查看全部)
1. D’Haens, G. et al. Risankizumab as induction therapy for Crohn’s disease: results from the phase 3 ADVANCE and MOTIVATE induction trials. Lancet 399, 2015–2030 (2022).
2. Ferrante, M. et al. Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial. Lancet 399, 2031–2046 (2022).
3. Sandborn, W. J. et al. Guselkumab for the treatment of Crohn’s disease: induction results from the phase 2 GALAXI-1 study. Gastroenterology 162, 1650–1664.e8 (2022).
4. D’Heans, G. et al. OP26 efficacy and safety of mirikizumab as induction therapy in patients with moderately to severely active ulcerative colitis: results from the phase 3 LUCENT-1 study. J. Crohns Colitis 16 (Suppl. 1), i028–i029 (2022).
5. Danese, S. et al. Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: results from three phase 3, multicentre, double-blind, randomised trials. Lancet 399, 2113–2128 (2022).
6. Matsuoka, K. et al. AJM300 (carotegrast methyl), an oral antagonist of α4-integrin, as induction therapy for patients with moderately active ulcerative colitis: a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Gastroenterol. Hepatol. 7, 648–657 (2022).
7. Sands, B. E. et al. Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. N. Engl. J. Med. 381, 1215–1226 (2019).
8. Sands, B. E. et al. Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 399, 2200–2211 (2022).
9. Burr, N. E., Gracie, D. J., Black, C. J. & Ford, A. C. Efficacy of biological therapies and small molecules in moderate to severe ulcerative colitis: systematic review and network meta-analysis. Gut 71, 1976–1987 (2022).
10. Barberio, B., Gracie, D. J., Black, C. J. & Ford, A. C. Efficacy of biological therapies and small molecules in induction and maintenance of remission in luminal Crohn’s disease: systematic review and network meta-analysis. Gut https://doi.org/10.1136/gutjnl-2022-328052 (2022).


