在自然环境中,细菌通常定居在复杂的群落中,并通过互相合作的方式,支持群落的发展,抵御敌人或抗生素等药物。那么细菌之间的是如何分工合作的呢?我们应该如何利用这些互作方式来解决耐药性问题呢?
今天,我们共同关注细菌间的相互作用。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
一只白蚁蚁后坐在脏兮兮的宝座上,浑身都是卵,并被她那些没有生殖能力的“臣民”照料着。蚁群中不同的蚂蚁有着不同的分工,并且只只都是各自工作领域内的专家:工蚁负责觅食和建造蚁丘,而兵蚁则保卫蚁丘免受入侵者的侵害。
社会性昆虫的分工能够实现群体效率的最大化,以确保“皇室”基因能够传给下一代。然而,在它们周围的土壤中,类似的场景也出现于另一个生命领域。
丹麦技术大学的微生物学家Ákos Kovács说,细菌的进化与鸟类和蜜蜂等高等真核生物有很多共同之处。他补充道,研究单细胞生物可能有助于科学家更好地了解多细胞生命。
Kovács团队研究的是“社会微生物学”,这是一个研究微生物社会生活的新兴领域。与实验室中通常研究的自由生活的或游动细菌不同,自然界中的大多数原核生物都定居在复杂的群落中。这些群落通常由若干个存在相互作用的物种组成。
这些富集了微生物的生物膜无处不在——岩石上、浴缸上和医疗设备上。事实上,你现在就正在支持一大堆这样的群落。未刷牙的牙齿上黏糊糊的涂层就是生物膜,并且,皮肤上和肠道中的有益微生物通常也会协同生长。
当一群细菌被糖、蛋白质和DNA组成的粘性混合物覆盖时,就形成了生物膜。这种细胞外基质将细菌粘在表面,并充当着一个粘稠的盾牌,保护内部的细胞免受捕食者和抗生素的侵害。常规药物会被困在基质和分子网中,无法穿透生物膜达到内层。
更重要的是,缺氧会导致中心的细胞进入类似冬眠的状态,使它们对靶向代谢过程的抗生素产生耐受性。事实上,生物膜可以承受比游动细菌高1000倍的剂量。
在生物膜内,细菌承担着不同的职责。一些细菌个体专注于繁殖以扩大菌群群落,而另一些则专注于构建,渗出多糖和蛋白质,构建细胞外的基质。还有一些细菌负责保卫这个群落,制造分子武器,用毒素攻击竞争对手。
这些任务并非终身固定不变。随着生物膜的成熟和群落需求的改变,单个细菌可能会承担新的责任。Kovács的研究小组发现,在土壤细菌枯草芽孢杆菌(Bacillus subtilis)种群中,大多数微生物在早期发育过程中承担了生产基质的职责。此前它们只不过是一群不相连的细胞,但是一旦开始构建基质,一些细胞就会转而生产孢子或有用的酶1。
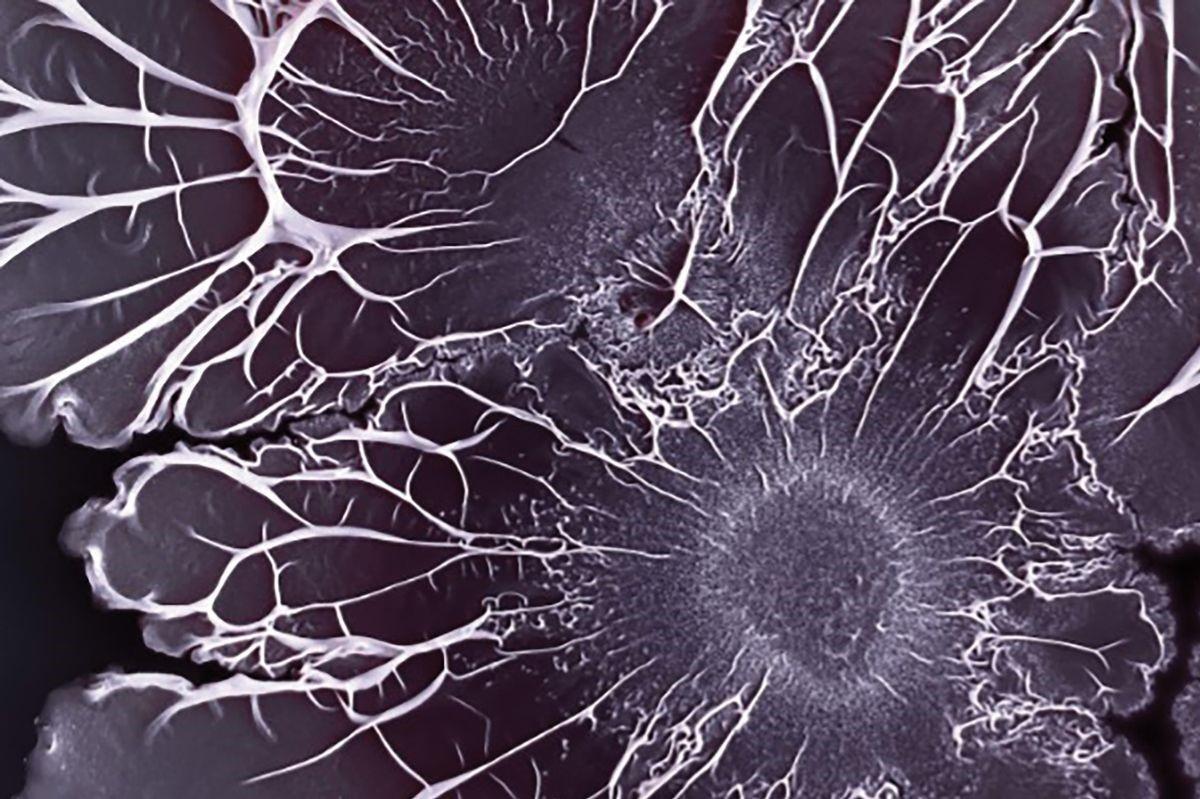
枯草芽孢杆菌形成的复杂生物膜结构。
那么,细菌是如何分配工作的呢?Kovács说,这在一定程度上是随机的。通过放大细胞反应中的随机波动,让单个细菌专门发挥不同的作用。例如,枯草芽孢杆菌生物膜内参与蛋白酶生产的细胞是随机的。
魏茨曼科学研究所的微生物系统研究员Daniel Dar表示,任务分配也可能受到细菌在生物膜中的位置的影响。就像一个城市不同行政区的空气污染程度或有机超市的丰富程度不同一样,生物膜的不同部分会暴露于不同水平的氧气和营养物质。细菌感知这些微环境,并通过调节某些基因的表达来影响不同的细胞过程。
Dar在加州理工学院Dianne Newman实验室做博士后研究员时开发了一种以亚微米分辨率追踪整个生物膜上基因活动的方法。他使用一种叫做并行连续荧光原位杂交(par-seqFISH)的工具对铜绿假单胞菌(Pseudomonas aeruginosa)种群进行了检测,这种细菌常见于囊性纤维化患者肺部。
连续FISH不像标准FISH那样用单一的荧光基团检测每个基因2,而是采用多个探针靶向转录本的不同区域,然后根据颜色序列解码其身份。Dar在一次实验中对细菌生长的多个阶段——从游动生物到成熟的生物膜——运用了这种技术。
通过检测100多个基因3,研究人员发现了一个看起来像按颜色划分的分区规划地图。不同的细菌集群显示出不同的基因活动模式,这些模式与代谢状态的改变相对应,具体取决于它们在生物膜中的位置。
例如,成熟生物膜底部的微生物激活了一组编码消化酶的基因,而它们西面的邻居则优先转录参与防御的基因4。
其中一种防御机制是在细菌开始聚集时促进绿脓杆菌素的产生。绿脓杆菌素是铜绿假单胞菌产生的一种可以影响其他细菌种类的毒素。随着生物膜的形成,细菌细胞团合成绿脓杆菌素,并通过自我毁灭来释放它。细菌一旦爆裂,会将毒素和DNA散布到周围的环境中。
这种看似自杀的行为为生物膜提供了最好的生存机会:毒素杀死竞争对手,而DNA与基质内的分子结合,加强其结构,加速生物膜的生长。
虽然该工具可以为生物膜感染的治疗提供新的线索,但研究人员还需要考虑环境因素。
“如果不了解环境,就很难理解行为。”Newman说。她与化学家合作,致力于用可视化的方法反映代谢物水平。她尝试实现这一目标的方法之一是通过标记氧分子来照亮含氧末端和缺氧内核之间的梯度。结合空间转录组学技术和其他方法,该方法可以让研究人员了解生物膜内的条件如何决定细菌行为。
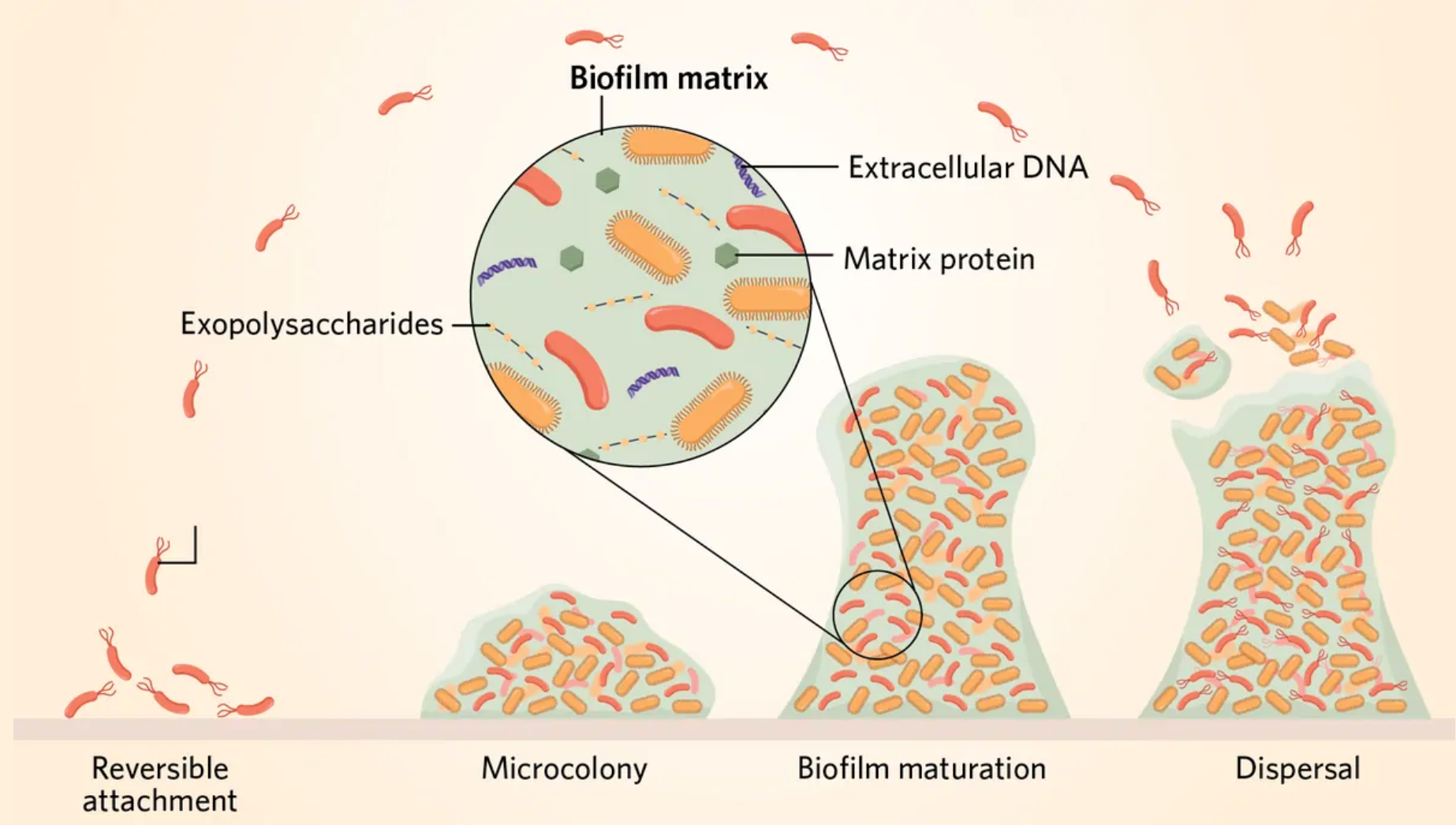
分工不仅源于基因表达的差异,还可能由不可逆的基因变化引发。在一种能形成真菌样结构的、生活在土壤中的细菌——天蓝色链霉菌(Streptomyces coelicolor)中,其染色体的大块缺失会导致一个细胞亚群专门合成抗生素。用于治疗人类感染的抗生素中有一半以上是由天蓝色链霉菌产生的3。
虽然这些细菌一开始是群聚的,但不稳定的DNA区域很快就会发生突变。在今年发表在Molecular Systems Biology上的一篇论文中,科学家们报告了天蓝色链霉菌基因组是如何被分成两个主要部分的4。
染色体较稳定的一端包含合成抗生素的基因,而促进生长的基因则位于较脆弱的一端。这些微小区域的突变通常会消除与生长和复制相关的序列,从而产生专门分泌抗生素的菌株。
然而,专业化是有代价的。就像没有繁殖能力的工蚁一样,抗生素生产者不太可能繁殖,但整个群体都从它们的劳动中受益。在某些情况下,突变体释放孢子的可能性降低了1万倍。
还有研究揭示了遗传多样性拥有更好隐蔽性的原因。在2022年发表在Cell杂志上的一篇论文中,研究人员描述了微生物如何用毒素杀死它们的同胞以推动有用突变的出现5。
为了抵御竞争对手,革兰氏阴性细菌组装了一种被称为VI型分泌系统(T6SS)的分子机关枪。这种武器形状像长矛,装有毒素,通过刺穿“敌人”的细胞壁将毒素射入到“敌人”体内。为了避免自身中毒,释放毒素的细菌会合成中和毒素的免疫蛋白。
几十年来,科学家们一直知道细菌会利用T6SS消灭自身的非亲属邻居,或入侵它们领土的陌生人。但没人想到它还会被用来杀死它们自己的兄弟姐妹,普林斯顿大学分子生物学家、细菌通讯研究的早期先驱Bonnie Bassler说道。
该研究解释了研究人员称之为扇形划分的现象,即生物膜会根据遗传变异被划分为不同的区域,尽管最初的细菌是一个单克隆。
Bassler的团队培养了导致霍乱的霍乱弧菌(Vibrio cholerae)组成的生物膜。在种群被划分成并形成不同的突变体区域之前,生物膜内的细胞开始用毒素射击它们的邻居。“它们疯狂地互相残杀。”Bassler说。
为了节省能量,只有当周围有大量其他微生物时,细菌才会开始组装它们的分子武器。这一过程由一种叫作群体感应的机制控制,这是细菌交流的一种形式。每个细菌都会释放化学物质。化学物质的浓度会随着种群浓度的增长而增加。一旦达到阈值,细菌就会激活群体感应基因,触发生物膜形成等群体行为。
微生物大屠杀可能会推动能够抵抗杀戮的群体感应突变体的出现,例如合成更多可作为防护装甲的多糖变体7。Bassler团队在霍乱弧菌研究中发现的一些突变体被发现也存在于临床样本中,这表明亲属间的杀戮可能是导致耐药性的罪魁祸首。
Bassler表示,细菌谋杀自己的兄弟姐妹可能是加速进化的一种方式。细菌以各种方式发生变异,但是,“只有能够抵抗T6SS杀伤效果的突变体才能生存和复制,因此它们才会蓬勃发展。”她补充道。
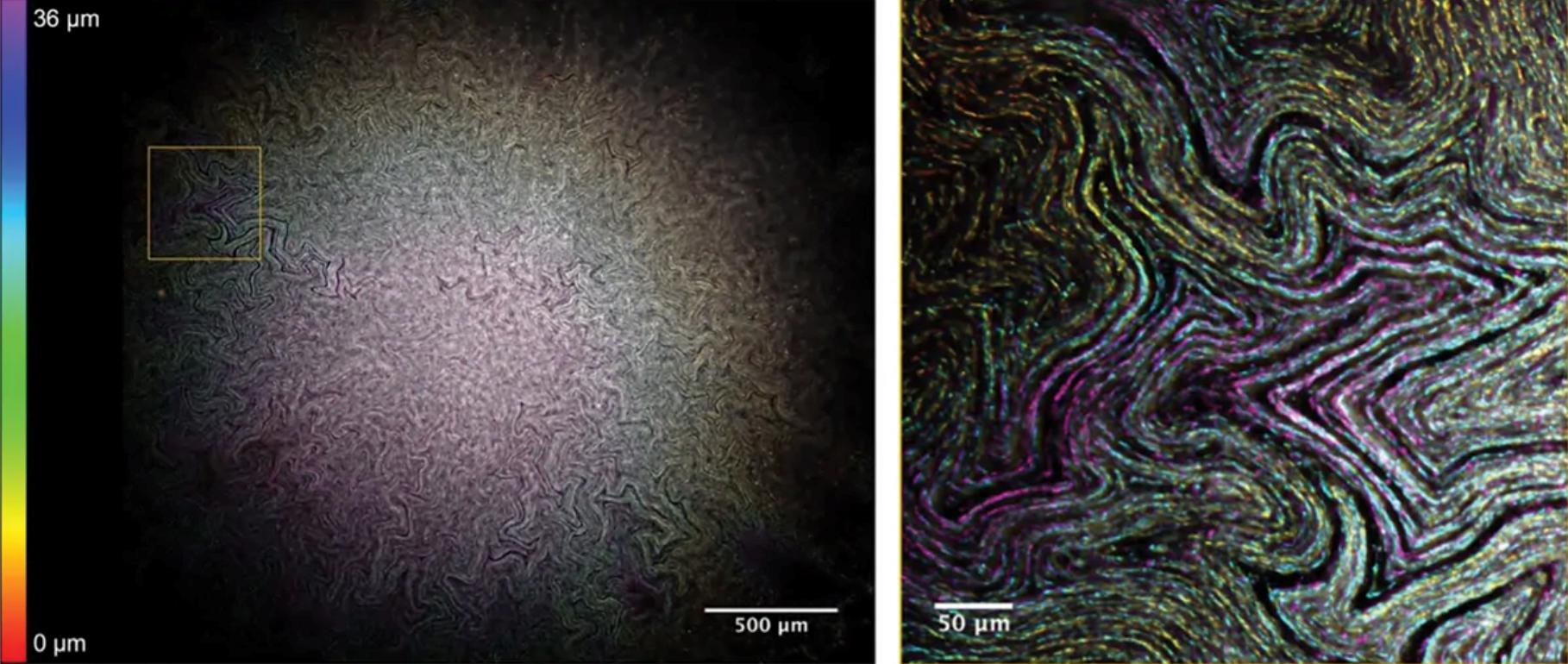
大肠杆菌生物膜中的通道结构。
通过了解分工是被怎样控制的,研究人员或许能够破坏这一过程,从而引发群落的整体崩溃。初步的研究结果表明电力可以做到这一点。
电流可以杀死细菌,但微弱的电流也可以刺激特定细胞类型的生长,加州大学圣地亚哥分校的生物物理学家Gürol Süel表示。
在过去的十年里,Süel的团队发现了细菌间如何通过电脉冲进行交流,这一过程如同一个巨大的动作电位穿过整个生物膜。电信号允许生物膜内的细胞调节生长8、分享营养9并招募外来者加入菌群10。
在最新的一项研究中11,Süel的团队专注于生物膜中的2种主要细胞类型:游动细胞和基质分泌细胞,前者游离群落并在新表面定居,后者产生粘性聚合物,将其余细胞群落粘合在一起。
该团队开发了一种设备,用电去刺激不断增长的枯草芽孢杆菌生物膜。尽管所有的细胞基因相同并暴露在相同的微环境中,但弱电击会促进游动细胞生长,而不促进基质分泌细胞的生长。并且电刺激会导致群落内细胞类型的比例失衡——群落很快就会被游动细胞吞并11。
研究人员建议,这可能导致生物膜的“破裂”,因为产生的基质较少,无法将群落聚集在一起。他们补充道,由于基质分泌细胞还阻止了抗生素进入生物膜核心,因此这可能会使细菌更容易被药物攻击。通过职责转换来分散细菌群落是Süel团队目前正在追求的目标。
Kovacs说,另一个有前途的策略是针对共享的物质、消化酶、基质聚合物和分泌系统,它们可以让微生物群落茁壮成长。当常规抗生素应用于生物膜时,耐药细胞很快就会占据上风并接管菌群。
但是,当细菌暴露于抑制“公共营养”的药物时,耐药细胞就会受到非耐药细胞的摆布。新资源可以被周围的细胞共享和利用,这意味着非耐药细胞无需消耗任何能量即可受益。非耐药细胞占上风,不断生长,直到公共营养耗尽,生物膜散去。
比利时鲁汶大学的微生物学家Hans Steenackers及同事在实验室中测试了这一方法12。他们培养了无法合成基质聚合物的沙门氏菌。与野生型不同,Steenacker所使用的突变细菌不太能形成生物膜,而且更容易受到抗生素的影响。
在为期40天的实验中,实验组中没有细胞产生耐药性,而对照组,也就是采用标准抗生素的组别中,几天内就出现了耐药细菌。该团队挑选了一些耐药菌株,并将它们添加到培养皿中,很快非耐药细菌就战胜了它们的邻居12。
Steenackers在一篇关于该主题的综述中写道,干预公共行为具有超越微生物学的潜力13。该策略可以被扩展到癌症治疗,因为癌细胞也是在类似的微环境中增殖的。
此外,也可以用以驱散昆虫群。Steenackers认为,昆虫通过信息素进行交流的方式类似于细菌通过群体感应进行交流,因此破坏其合作可能是一种比典型杀虫剂更可持续的方法。Kovács表示,研究细菌合作不仅是靶向致病生物膜的关键,而且还可以揭示多细胞生命的情况。
空间转录组学可以通过识别生物膜形成所必需的蛋白质,为如何将抗生素潜入生物膜坚不可摧的内核提供线索。
Dar的par-seqFISH技术指出了一组被称为吩嗪的代谢物,是铜绿假单胞菌开始聚集在一起时表达的。这一发现支持了Dianne Newman小组之前关于绿脓杆菌素(一种吩嗪)如何促进细菌细胞相互作用的数据。
使用PodA酶破坏绿脓杆菌素可以使生物膜更容易受到抗生素的影响,但PodA酶不够稳定并且自然合成的数量很少。
Newman与Sarel Fleishman合作想出了一种调整PodA结构的方法。Fleishman是魏茨曼科学研究所的结构生物学家,他使用一种计算方法来预测增加蛋白质稳定性的突变。当 Newman的团队将优化后的酶应用于铜绿假单胞菌种群时,抗生素破坏了更大比例的生物膜。
光学显微镜的进步为削弱生物膜提供了其他线索。通过重新设计物镜,英国斯特拉斯克莱德大学的物理学家Gail McConnell开发了一种工具,可以在单次拍摄中以高分辨率和更大放大倍率对胚胎进行成像。
随着Liam Rooney加入McConnell的实验室时,他成为第一个接触这一工具的微生物学家,也让我们得以一窥微生物之城的内部运作。
在Rooney开始这个项目之前,他从未见过生物膜内部的高分辨率图像。Rooney表示:“我们以为它只是一个由同质细胞组成的球,密密麻麻,没有真正的内部结构。”
通过将称为Mesolens的工具应用于大肠杆菌生物膜,该团队观察到一个蜿蜒穿过菌落内部的微观水通道网络。这些管道可能有助于生物膜将营养物质、氧气和其他资源输送到饥饿的内核,就像我们的血管一样。Rooney表示,我们可以利用这些通道将抗生素转移到生物膜的中心。
参考文献:
(滑动查看全部)
1. Otto SB, et al. Privatization of biofilm matrix in structurally heterogeneous biofilms. mSystems. 2020; 5(4): e00425-20.
2. Eng CHL, et al. Transcriptome-scale super-resolved imaging in tissues by RNA seqFISH+. Nature. 2019; 568(7751): 235–239.
3. Dar D, et al. Spatial transcriptomics of planktonic and sessile bacterial populations at single-cell resolution. Science. 2021; 373(6556): eabi4882.
4. Zhang Z, et al. Antibiotic production in Streptomyces is organized by a division of labor through terminal genomic differentiation. Sci Adv. 2020; 6(3): eaay5781.
5. Colizzi ER, et al. Evolution of genome fragility enables microbial divisions of labor. Mol Syst Biol. 2023; 19(3): e11353.
6. Mashruwala AA, et al. Quorum-sensing- and type VI secretion-mediated spatiotemporal cell death drives genetic diversity in Vibrio cholerae. Cell. 2022; 185(21):3988-3979.
7. Toska J, et al. Exopolysaccharide protects Vibrio cholerae from exogenous attacks by the type 6 secretion system. PNAS. 2018; 115(31): 7997-8002.
8. Prindle A, et al. Ion channels enable electrical communication in bacterial communities. Nature. 2015; 527(7576): 59–63.
9. Liu JT et al. Coupling between distant biofilms and emergence of nutrient time-sharing. Science. 2017; 356(6338): 638-642.
10. Humphries J, et al. Species-independent attraction to biofilms through electrical signaling. Cell. 2017; 168(1-2): 200-209.
11. Comerci CJ, et al. Localized electrical stimulation triggers cell-type specific proliferations in biofilms. Cell Syst. 2022; 13(6):488-498.
12. Dieltjens L, et al. Inhibiting bacterial cooperation is an evolutionarily robust anti-biofilm strategy. Nat Comms. 2020; 11: 107.
13. Lissens M, et al. Evolution-proof inhibitors of public good cooperation: a screening strategy inspired by social evolution theory. FEMS Microbiol Rev. 2022; 46(5):1-18.


