宿主与其肠道菌群的共生关系在漫长的演化过程中不断磨合,宿主遗传学因素对肠道菌群多样性和特定类群丰度的影响已得到公认,但对于人类基因组与肠道微生物组间的遗传学互作,目前仍所知甚少。荷兰格罗宁根大学傅静远教授团队与合作者在Nature发表的一项最新研究,对荷兰9000多人的人类遗传变异SNP与肠道微生物基因组结构变异(SV)之间的关联进行了荟萃分析,发现了特定肠菌SV与人类ABO血型和分泌型状态间的密切关系,揭示了该关联背后的肠菌代谢途径(利用宿主分泌的特定糖分子作为碳源),探索了肠菌的这一代谢功能在宿主ABO基因型与特定肠菌丰度关联中的介导作用,以及对宿主健康的潜在影响。总之,该研究揭示了人体“第一基因组”与共生菌群“第二基因组”之间交互作用的冰山一角,表明人类基因组和肠道微生物组中的基因关联可以为宿主与菌群间的相互关系提供功能性见解,把研究深度从分析微生物种类进一步推向菌群的功能通路和基因水平。
专家访谈
Q:祝贺傅老师带领团队再发重要成果!请问您觉得这项研究最大的突破和亮点有哪些?
傅静远教授:最大的亮点在于通过人类基因组与宏基因组的基因变异之间的关联分析,从而对两者的交互作用提供进一步的因制了解。
人类基因型对菌种丰度和菌群稳态的调控作用过去已经有了很多研究,但是到底是通过什么方式进行调控的,还知之甚少。另外在人类漫长的进化史中,人类的基因型和菌群的宏基因型可能存在一个协同进化的过程。
我们试图从双方基因变异型上找出关联和依据。虽然我们发现的ABO位点,过去已发现与某些菌群丰度相关,但通过分析结构变异,我们鉴定出其中的具体的菌群GalNAc代谢通路,而富有此通路的人类肠菌与之前在猪肠道中发现的菌(点击查看)又不同。而且我们通过肠菌分离、体外培养的方法发现此通路是肠菌利用GalNAc的必要通路,并且可能是一个可转移、可翻转的基因片断,可以提高肠菌在资源利用上的灵活性。
Q:这项研究表明GalNAc利用基因与黏膜A抗原者的健康指标之间具有较强的关联。请问该如何理解这种关联性?菌群GalNAc基因是否对宿主健康有益呢?其机制可能有哪些?
傅静远教授:我们觉得这样的关联可能是一个间接的关系。GalNAc通路被证实为GalNAc利用的必要通路,而分泌型A型抗原是黏膜GalNAc的主要来源,那么具备这个通路的肠菌在黏膜A抗原者具有更强的生长优势。而拥有该通路的,正好是肠菌中的健康有益菌——普氏粪杆菌(Faecalibacterium prausnitzii,也称普拉梭菌),它对菌群多样性、稳态和人体健康都有着促进作用。
因此我们认为,GalNAc对人体健康并不一定有直接的作用,可能是通过提高健康有益菌的生长优势,而促进人体健康。
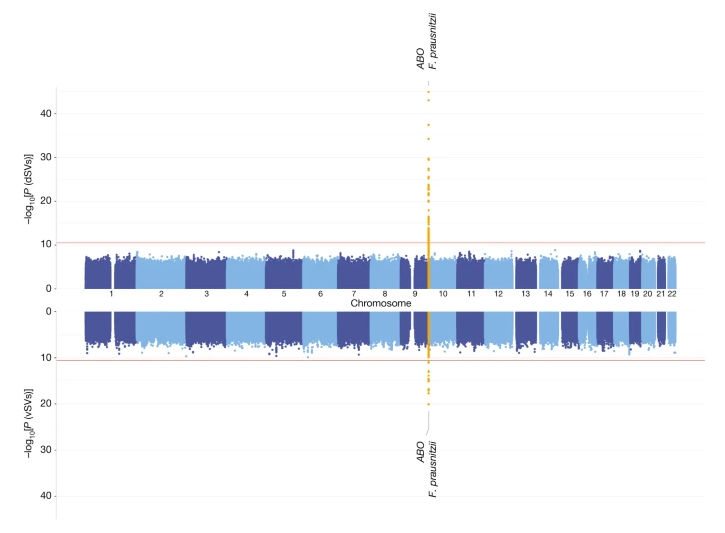
图1 人类ABO位点与普氏粪杆菌基因结构变异相关
(引自Nature. 2024 Jan 3. doi: 10.1038/s41586-023-06893-w)
Q:除了特定的分泌型营养物质,如本研究发现的GalNAc,宿主遗传因素还可能通过哪些机制影响菌群?除了ABO位点,您们还有哪些有意思的发现?
傅静远教授:一般认为主要是通过免疫和代谢两方面影响菌群,但是大部分具体的机制还不明了,还有待进一步研究。
在研究中,我们还确定了200多个位点与菌群的结构变异可能存在相关性,但信号强度还是不是特别显著。这些位点包含了一些免疫、代谢、基因表达调控等的基因,比如OSBPL1A、FGF9、ERG等,但是它们对肠道菌群的调控作用还不清楚。其中有一些与人体疾病也存在关联,可能值得更一步关注。比如KCNJ15基因编码一个内向整流钾通道基因,而相关通道基因与炎症性肠病(IBD)存在关联,且钾通道调节剂可用于IBD的治疗。
Q:普氏粪杆菌是微生物组研究领域中比较公认的具有前景的二代益生菌。您团队这次的发现对于普氏粪杆菌及其他活体生物药的转化研究具有哪些指导和借鉴意义?
傅静远教授:目前益生菌或其他针对菌群的干预手段的预后效果存在着很大的个体差异,我们的研究有可能提供了一个很好的思路。
具体来说,我们的血型可能影响不同菌株在肠道的定植和生长能力,匹配基因型与菌株型可能实现更好的干预效果。对于分泌型A型血的个体,编码GalNAc代谢通路的普氏粪杆菌具有更强的定植和生长优势,并对人体健康显示更显著的正相关作用。因此在未来的转化研究中,我们更需强调个体化的益生菌开发。
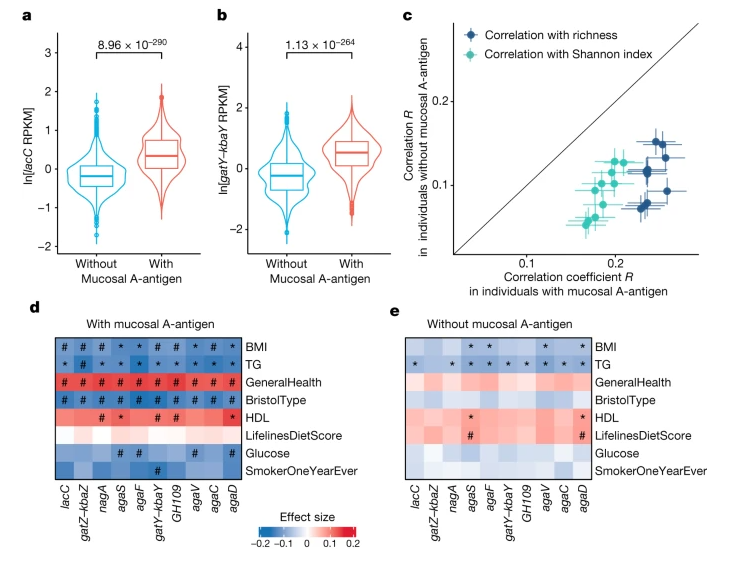
图2 肠菌GalNAc基因与黏膜A抗原和非黏膜A抗原个体的关联比较
(引自Nature. 2024 Jan 3. doi: 10.1038/s41586-023-06893-w)
Q:您和团队从2021年在Cell发表研究以来,一直在引领对菌群基因组结构变异的研究。是什么促使您开展这方面研究的?这对于菌群研究和转化应用具有哪些重要价值?
傅静远教授:最近10多年来,人体肠道菌群的研究借助于新一代测序的方法迎来了新的高潮,肠道菌群对人体健康的重要性也提到了一个新的高度,包括科研、医疗、农业、食品营养加工和环境等各领域,都对菌群可能带来科技创新充满期待。但菌群是一个非常复杂的生态系统,如果研究工作仅停留在种属丰度水平上,则无法对菌群的功能进行更深入的挖掘。
肠菌可能“同种不一定同工”,意即同一种属里的不同菌株可能在功能上大不相同。过去,我们一直缺乏可以较为准确地从种属或菌株中定位具体功能基因的有效方法。因此,我的研究团队在过去几年的时间内一直在研究开发如何利用肠道菌群的遗传变异,例如结构变异,来探寻潜在的功能基因。
Q:在研究宿主-微生物组相互作用方面,微生物组全基因组关联研究(GWAS)是非常重要的研究手段,但目前这一领域的研究似乎依然比较有限。您觉得该领域目前有哪些主要的挑战和困难?应当如何克服?该领域的研究发现能为理解和研究宿主相关微生物组提供哪些洞见?
傅静远教授:这项研究工作还处于很初期的阶段,主要的挑战和困难包括:宿主基因型对菌群的调控作用普便小于环境的作用,微生物组GWAS需要大量的样本来达到统计的显著性。
我们去年发表在Nature Genetics的观点文章(点击查看)专门讨论了相应的效力分析,样本量至少需达3万到13万人不等,从而有80%的效力探测到可解释0.4%的个体差异的遗传位点。而饮食、环境对菌群的影响很难进行有效的定量和修正,从而大大降低了微生物组GWAS的效力和可重复性。我们很高兴在本研究中ABO与普氏粪杆菌GalNAc代谢途径的相关作用可以在来自非洲的塔桑尼亚的队列中验证到。
最重要的是,我们对宿主基因型对菌群调控的基制一无所知,其中一位审稿人对我们的研究给予高度评价:“此研究克服了两大主要挑战(即缺乏菌株水平分辨率和实验验证),据我所知,是第一个证明并通过试验验证人体上的这种关联,并且是第一个报告宿主遗传对微生物群菌株的影响的研究,这代表了一项重大进展。这项研究是迄今为止对宿主遗传对肠道微生物组影响进行的最全面的研究,它提供了一种极好的方法,可以用于其他人类(和非人类宿主)人群的未来研究。总的来说,这个研究是我们理解人类遗传学对肠道宏基因组的影响(以及产生未来理解的能力)的重要一步。鉴于人们越来越认识到肠道微生物群菌株水平变异对人类健康的重要性,以及新出现的证据表明人类和肠道微生物可能共同进化,这是一个及时而重要的问题。”
Q:这是您团队近3年来第三次在顶刊发表研究成果,非常令人钦佩,尤其是对于女科学家而言。可否请您分享一点您的个人经验?
傅静远教授:这也要归功于团队的努力、合作方的支持和良好的资源和平台(比如Lifelines 队列),以及有效调动各方人员的各尽所长、亲密合作是非常关键的。
比如三位共同第一作者都发挥了不可缺少的作用。团队中的博士后Dasha Zhernakova首先引领了这个工作,发现了A型抗原与普氏粪杆菌的一个基因组片断的显著关系。另一位博后王道明博士对该片断进行了进一步的基因分析,组构了完整的GalNAc通路,完善了猜想。博四研究生刘磊则进行了细菌培养和实验验证工作。三位共同第一作者分工清晰、合作无间,完成了发现-猜想-验证三步曲。我为他们深感骄傲!


