编者按:
药物微生物组学是研究菌群与药物反应、代谢的一类新兴领域,药物可影响肠道菌群的组成与功能,反过来肠道群菌也会直接参与药物的代谢,影响药物的效力与毒性,还会与免疫系统互作,间接地影响药物反应和生物利用度。
在精准医疗走向微观化的时代,基于对人群的追踪研究及对个体的体外药物测试,可以帮助我们加深对宿主-菌群-药物的互作的理解,结合药物基因组学,实现对菌群的精准干预、预测个体对药物反应等都有助于我们向精准医疗的持续迈进。
药物微生物组学的兴起
下次,在吞下药片的时候,你或许会想到:你不是唯一消化这药片的。你甚至有可能不是最先消化这药片的。
现在绝大多数人都知道我们的肠道中充满了大量的微生物,绝大多数与我们和谐相处,帮助我们分解食物、合成维生素、抵抗病菌并将化学信号传递给大脑和免疫系统。
不过,药物微生物组学——这一新兴研究领域正逐渐证明我们内部微小的“正常居民”不仅能以有益的方式代谢药物,也能以有害宿主的方式代谢药物。
肠道中的帮手与敌人
以左旋多巴(L-dopa)为例,这是治疗帕金森病的主要药物成分。当它进入大脑后,会转变成多巴胺。通常左旋多巴会与卡比多巴(carbidopa)联用,后者可防止左旋多巴在穿越血脑屏障之前被人体内的酶分解。
尽管如此,实际到达大脑的左旋多巴的剂量还是因人而异,直到最近原因才逐渐明朗。
在小肠中发现的细菌酪氨酸脱羧酶,可以将左旋多巴转化为多巴胺,意想不到的是,卡比多巴并不能阻止该过程,因为它对细菌脱羧酶不起作用。
Science 于 2019 年发表了一项研究,实际上,卡比多巴在对抗这些微生物上是“完全无效”的。基于此,开发广谱酶抑制剂或利用辅助因子破坏酶的活性,或有望对帕金森病进行精准的治疗。
文章的通讯作者哈佛大学的化学教授 Emily Balskus 说道,这些搞破坏的敌对分子数量因人而异,这也就解释了为什么有些病人服用左旋多巴后药效没有其他人的强。
微生物还可以破坏用于治疗心律不齐和心力衰竭心脏病经典药物地高辛(digoxin)。
医生很早就知道约有 10%患者使用地高辛中不会获益,因为大部分的药物,某些情况下甚至超过 50%,都被肠道细菌迟缓埃格特菌(Eggerthella lenta)灭活了。
不过,加州大学旧金山分校的微生物学家 Peter Turnbaugh 的新研究表明,实际上,只有少数特定 E. lenta 菌株具备这种能力。
当然,体内的微生物也会帮助我们。例如广泛用于类风湿性关节炎、克罗恩病和溃疡性结肠炎的药物柳氮磺吡啶(sulfasalazine),如果没有肠道细菌,就无法将该药物的一个化学键断裂,将它代谢成激活状态,也就意味着这种药是无效的。
而且,有好几种口服抗生素都像柳氮磺吡啶这样。
另一种获得微生物援手的药物是治疗 Ⅱ 型糖尿病的一线药物——二甲双胍(metformin)。
二甲双胍与微生物之间更多的是双向作用。最近的研究表明,二甲双胍在某种程度上改变了肠道菌群,使得二甲双胍更加有效。至于说它到底是怎样做到这一点的,仍然是个谜。
这些个案表明细菌药物代谢是一种普遍机制,胃肠道和生殖道中的微生物,甚至在疾病组织内的微生物都会影响药物的反应。
【关于药物微生物组研究的更多信息,推荐阅读:傅静远团队 | 对菌群影响药效和毒性的最全面总结(12000 字)】
伦敦帝国理工学院的代谢组学开拓者 Jeremy K. Nicholson 教授坚定地认为细菌会很大程度上影响机体对药物的反应。他表示“代谢很大程度上是由环境因素决定的:你是否处于压力状态下,你的肠道菌群是什么样的——这些都已经被证实是相当重要的。”
而针对这些问题,科学家们开始尝试精准调节微生物以改善药效,其中最令人振奋的成果就是伊立替康了。
精准调节微生物
伊立替康与其他药物联用以治疗晚期结肠癌和胰腺癌,该药物是肿瘤细胞的强大杀手,但会引起严重的腹泻和肠道损伤,因此许多患者无法耐受有效剂量以治疗其癌症。
北卡罗来纳大学教堂山分校的药学家 Matthew Redinbo 将问题归结于肠杆菌科这一细菌家族(科内成员有沙门氏菌和大肠杆菌)。
静脉注射的伊立替康循环至肿瘤处发挥毒性,以起到杀死肿瘤细胞的作用,然后在肝脏中进行代谢减弱其毒性,该过程具体是通过在其分子结构上添加一个单糖实现。
然而,不幸的是“微生物喜爱甜食”,因此当减毒后的伊立替康到达肠道排出体外时,这些细菌会吃掉单糖重新激活药物的毒性,于是,伊立替康在癌症患者体内上演了一出“大闹肠道”。
Redinbo 受一位年轻同事与结肠癌和伊立替康的副作用作斗争的激励,开发出了一种阻止微生物吃糖的小分子药,从而使药物可以无害地通过肠道。在动物实验中这种小分子药减弱了肠道毒性,因此他也希望能在化疗患者中进行测试。
Redinbo 合伙创建的公司 Symberix 也正在研究另一种药物,可预防由非甾体抗炎药(NSAID)这类常见止痛药引起的肠道不适和溃疡,例如布洛芬和萘普生。这些副作用同样是由嗜糖细菌造成的,并且对长期使用 NSAID 的患者来说,非常可怕。
如果 Redinbo 和他的同事们成功,他们将能够为精确调节微生物改善药效打开一扇大门。
与此同时,Balskus 和她的团队正在测试一种阻止细菌分解左旋多巴的分子。她表示,这是“一个等待被探索的药物研发新领域。”
虽说我们已经在药物微生物学领域取得了一定的进展,但目前来说我们也认识到此处的科学鸿沟仍然巨大。
在非抗生素药物对人体微生物组副作用的研究中,人体病理生理学、饮食结构、生活方式等其他因素的参与,使得药物与微生物的关系难以确定。
在微生物调节的免疫药物反应中,对于如何找出微生物参与药物反应的生物标志物仍有待研究。
在精准调节肠道微生物组中,建立一个完整的药物-微生物组相互作用的百科全书,从而进行个性化治疗仍需要进一步努力。
那么,我们要如何去探究药物与微生物之间的复杂关系呢?或许,我们需要从解决一些基本问题入手。
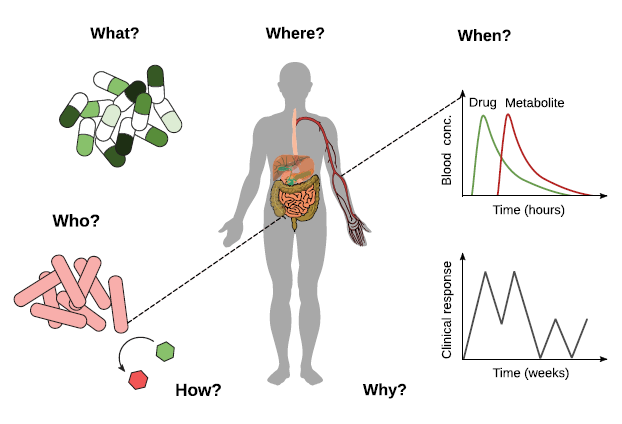
图片来源:Lam K N, et al. Cell host & microbe, 2019, 26(1): 22-34.
5个W+1个H
这些问题也就是 Who、What、When、Where、Why、以及 How。其目的是厘清微生物组影响疾病治疗的基本规律,从而帮助我们设计出更精准的干预手段。
Who?虽然我们现在已经知道某些关键微生物物种会参与到药物反应中,但是还需要去进一步阐明关键微生物物种对整个机体的系统性影响。
我们需要更加精准的预测模型和检测工具来探究复杂的肠道菌群中的哪些成员会参与到药代动力学和药效学中。我们需要改进方法,比如借助原位检测方法,直接在肠道中就定量肠道菌群的绝对丰度和活性。
What 和 How?当前,对肠道菌群直接代谢的一系列药物进行研究,可以为我们深挖背后的基因、生物化学和酶学机制奠定坚实的基础。因为对这些机制的研究可以预测宿主代谢药物时的可能趋势以及可能的作用机理。
而囊括了宏基因组、宏转录组、宏蛋白组以及宏代谢组的多组学技术联合应用将有助于刻画药物的完整生理作用,同时也能为深入剖析背后机理提供理论假设。
Where?长期以来,我们一直存在这样一个教条,认为微生物组只会影响远端肠道中的小分子物质。然而对左旋多巴的研究已表明微生物组能够影响药物的初级代谢,造成药物在小肠中快速降解。
实际上,我们对有关微生物组会涉及到的物理生态位仍然知之甚少,比如在哪些地方宿主会与微生物进行互作,又在哪些地方微生物组会进行信号传递等问题都尚不清楚。
许多研究已经开始鉴定特定部位的微生物组及其新陈代谢反应,这些工作无疑为我们在肠道及身体其它部位精确定位、调节微生物组奠定了基础。
When?现在我们都已清楚微生物组及其与宿主病理生理学上的互作是高度动态的,这就要求我们需要采用更加协同、高效的方式,从而锚定出一些关键反应过程是何时发生的。
我们需要测定微生物组在药代动力学上的快速影响,同时也要考虑到微生物组在短则几天,长则数年的治疗期间上的动力学特征,这些都是至关重要的。在治疗完成后,评估非抗生素药物对肠道菌群的持久影响上等问题同样值得考虑。
另外,对这一领域的研究能够让我们有机会重新审视药物响应随时间发生变化的机制。例如,癌症化疗为什么会出现广泛的抗药性问题。
Why?最后,或许也是最令人困惑的问题是,微生物组在药理学中为何能发挥直接或间接作用。
绝大多数的药物对人体来说是外来物质,正常情况下人体中是不存在的。当“外来物质”药物进入人体中,酶是如何在微生物基因组中“进化”及维持下去的呢?
通常的解释是有些微生物的酶其底物不仅包含外源性底物,也包含内源性底物。所以即便没有外来物质,这些酶也会发挥一定作用,一直被微生物携带。
然而也有例外,像是 Cgr2 酶(一种能使地高辛药物失活的酶),我们仍未弄清其内源性底物为何物。
还有我们已经知道微生物组与免疫系统的关系非常紧密,然而,令人吃惊的是,许多常见的细菌有效地激发了免疫反应,但是免疫反应反过来导致这些细菌被清除。

交叉学科,通力合作
在药物微生物组中,我们仍然面临着许许多多的挑战,所获取的认识也仅仅是冰山一角。如果我们在这一领域的研究工作无法取得长足进步,那么想要通过精确控制人类微生物组来治疗疾病这一梦想就很可能只是一个梦。
而想要取得突破性的进展,就需要不同领域的科学家们通力合作。
是的,虽然微生物组是一个刚刚兴起的领域,但是我们已经深刻认识到这一领域的“庞大”。
因为越来越多的科学研究已经证实了微生物组与机体的各个系统似乎都有关联,这也就意味着这一领域必然是一个多学科交叉,需要不同研究方向的科学家通力合作的领域。
而对药物微生物组来说,那么可能就需要微生物学、免疫学、药理学等方向的专家联合起来,一起来解决这些基础性问题。
参考资料:
(滑动下方文字查看)
1.Lam K N, et al. Cell host & microbe,2019, 26(1): 22-34.
2.Doestzada M, et al. Protein & cell,2018, 9(5): 432-445.
3.Savage N. Nature, 2020, 577(7792): S10.
4.https://www.scientificamerican.com/article/bugs-and-drugs/
5.https://www.scientificamerican.com/article/how-gut-microbes-shape-our-response-to-drugs/
作者 | Richard,猫
审校 | 617


