
本周日的大事件栏目,我们向大家介绍以下5条动态,尤其值得关注的是中国微生态制药企业的融资喜讯,以及治疗艰难梭菌感染的新型抗生素的开发。
OraSure 收购 Diversigen,全面布局微生物领域
AI 微生态制药公司未知君获超亿元人民币 B 轮融资
承葛生物完成数千万元融资,加速微生态药物研发
Summit 靶向 CDI 的精准抗生素进入临床三期
Acurx 的新型抗生素完成针对 CDI 的首次人体试验
2019年11月6日(当地时间),OraSure Technologies(NASDAQ: OSUR)宣布以全现金交易方式收购微生物组科研服务公司 Diversigen。这笔交易包括1200万美元的预付现金,以及根据2019年的营收表现来支付的剩余款项。

Diversigen 是一家微生物领域的科学家创办的公司,位于美国休斯顿,主要是为宏基因组测序、生物信息、数据分析等微生物组研究提供科学的定制化解决方案。
该公司成立于2013年,其创建者是贝勒医学院阿尔凯克宏基因组学与微生物组研究中心主任、分子病毒学与微生物学教授 Joseph Petrosino 博士,这也是贝勒医学院投资的一家公司。
![]()
Diversigen 是首家同时获得 CAP(美国病理学家协会)认证及 CLIA(美国临床试验室改进法案)认证的微生物组公司。该公司通过其微生物组创新工作流程,服务于大型药企以微生物组为核心的临床试验,这部分业务大概占了该公司90%的收入来源,其它是服务于领域内的创新企业。
OraSure Technologies 是一家纳斯达克上市公司,成立于2000年,总部位于美国宾夕法尼亚州。这是一家医疗设备及耗材公司,主要在美国、欧洲市场上从事唾液诊断产品和标本采集设备及其它诊断产品的研发和销售,其产品主要应用于危急医疗状况下的检测或诊断。
客户包括临床试验室、医院、诊所、社区组织、公共卫生机构、政府机构、医生办公室、商业和工业实体,还包括分销渠道和零售药店,以及团购和个人消费者。
该公司主要通过资本方式来增强其目标业务范围和创新能力,比如收购创新型企业。此前曾收购了三家相关公司,包括 DNA Genotek、CoreBiome 和 Novosanis。
2011年收购的加拿大 DNA Genotek 公司,是一家致力于为研究机构和企业提供高质量的生物样本的公司。
近两年,OraSure Technologies 尤其关注微生物组领域。今年1月该公司宣布收购微生物组测序服务公司 CoreBiome,这也是一家由微生物组领域的科学家创建的创业公司,有着实力强劲的科学顾问团队。今年4月份,微生物组领域的风云人物之一、加州大学圣地亚哥分校的 Rob Knight 教授成为该公司的科学顾问。
此次把 Diversigen 收入囊中之后,我们来看看 OraSure 有了一个什么样的公司组合,Diversigen 有微生物组方面的专业知识、生信数据分析的技术实力,以及成熟规范的工作流程;CoreBiome 有在微生物组测序及分析方面的技术创新;DNA Genotek 有创新的取样工具。
OraSure 通过资本的力量将这些微生物组创新者组合起来,应该会加速其在微生物组领域的创新驱动增长轨迹。
贝勒总裁、首席执行官和执行院长Paul Klotman博士对媒体表示,希望此合作能够加速贝勒医学院的科学成果向市场的转化。
本节参考资料:orasure 官网(www.orasure.com)
编者注:
以下是两家中国微生态领域创业公司在本周官宣的融资消息。虽然这两则融资消息已在媒体广泛报道,在大家的朋友圈里也不少传播,我们在今天的大事件里仍然需要划个重点。这代表着中国微生态行业的创新力量,以及资本对这个行业未来发展前景的看好。
![]()
未知君本周一(11月4日)早上在自己的公众号里正式官宣完成 B 轮融资,融资总额超过亿元人民币。本轮融资由君联资本领投,原有投资方高榕资本、晨兴资本、雅惠投资继续跟投。这笔融资被称为是“国内微生态制药行业迄今为止规模最大的融资事件”。
我们先来回顾一下未知君的融资历程:成立于2017年的未知君,2018年8月完成 A 轮融资,由高榕资本领投,晨兴资本和真格基金跟投;2019年初完成 A+轮融资,由力合泓鑫领投,雅惠投资跟投。这两轮融资总额共计近千万美元,未知君在今年6月份才正式对外官宣,每轮的具体融资金额并未透露。
未知君是一家布局微生态药物的平台型公司,成立刚满两年。目前已建立起了数据驱动的微生态制药临床前平台,为尚缺乏标准化的药物开发方案/方法的微生态制药提供了全链条 SOP。该平台下设六大子平台,包括从多组学的计算,到功能菌株发现、研发,再到生产的全部环节。
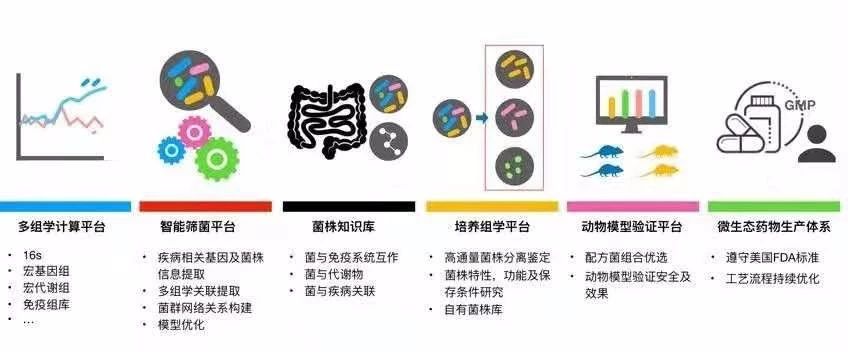 未知君的微生态药物开发平台
未知君的微生态药物开发平台
自今年6月宣布 A+ 轮融资以来,未知君已在各子平台上均取得不小进展。例如在生物信息和 AI 平台方面,未知君就定制改进了 Strainfinder 和 Panphlan 等菌株分析算法,提高了菌株检测分析的灵敏度和准确性。
经定制改进的 Panphlan 算法,已被应用于未知君与北大肿瘤医院的菌群移植(FMT)与抗 PD-1免疫抑制剂的联合治疗项目。此外,未知君还与上海新华医院展开了通过菌群移植进行自闭症患者治疗的临床研究。
上述项目均已进入人体实验阶段,并取得了优异的早期实验数据。目前,项目有关机构均在积极准备申报美国 FDA 的新药临床试验申请(IND)。
目前,未知君已经完成近 1000 株自有菌株的分离、筛选和功能验证实验,其中多个配方菌组合跟 PD-1抗体药物的联合治疗在动物实验上取得了突破性成果。因此,未知君目前正在和国内的多家制药公司进行积极的合作探讨,通过针对不同公司的 PD-1抗体药物进行配方菌的优化,将配方菌药物快速推向临床阶段。
点击下文可阅读未知君创始人、首席执行官谭验博士在2019中国肠道产业大会的演讲内容。
谭验:近90%菌群制药公司在美国,为什么中国却可能弯道超车?

承葛生物本周五(11月8日)早上在自己的公众号里发布官宣:承葛生物已经完成了天使轮和 PreA 轮融资,融资总额达数千万元人民币。天使轮融资由钟南山院士产学研集群企业广州呼研所医药科技有限公司领投,阳普湾创新企业孵化器跟投;PreA 轮融资由三泽创投领投,广华创投跟投,现已完成交割。
承葛生物表示,所获资金将用于进一步完善其自有的精准化菌群移植治疗平台,并加快推进微生态药物的研发。
成立于2016年的承葛生物,是中国首家提供精准化菌群移植治疗整体解决方案的企业,业务领域横跨医疗诊断、微生态治疗、微生态药物研发和医疗大数据挖掘。
承葛生物已建立了全球首个精准化菌群移植治疗平台(PMTT),依托这个平台不断拓展菌群移植适应症,并以平台积累的临床数据和多组学数据为基础,进行微生态药物的开发。
打造以肠道微生态为靶点的疾病预防、诊断、治疗及愈后评估、营养指导等一体化综合服务产业链,实现以微生态为靶点的全生命周期的健康管理,这是承葛生物未来努力的方向。
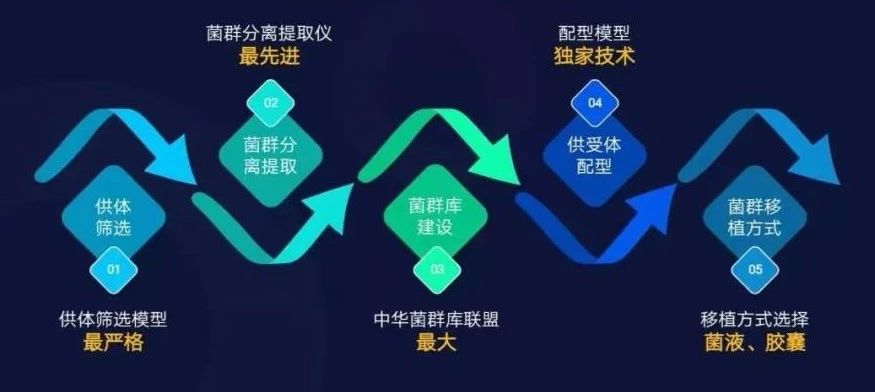 承葛生物的精准化菌群移植治疗平台(PMTT)
承葛生物的精准化菌群移植治疗平台(PMTT)
目前,承葛生物的菌群移植联合 PD1治疗三阴性乳腺癌获得国家癌症中心的基金立项,已进入临床研究,多项全国多中心临床研究也相继开展。承葛生物也已推动多个省份获得卫健委和医保局审批的菌群移植收费条码,合作医院已达数百家,涵盖全国28个省市。
承葛生物创始人、董事长肖传兴博士在创业前是厦门大学附属中山医院的消化科医生,那时候就开始在医院进行粪菌移植的研究。当医生是要花很多时间在门诊上的,为了投入更多时间在粪菌移植研究上,他决定辞职,于2016年5月创立了承葛生物,开启了精准化菌群移植治疗之路。2018年12月公司获得了高新技术企业认定。
编者注:
以下两篇都是关于治疗艰难梭菌感染(CDI)的新型抗生素的研究,目前粪菌移植(FMT)已成为 CDI 的有效治疗方法,新型的窄谱、精准抗生素也许会是另外一个选择。
在 Summit Therapeutics 公司(NASDAQ: SMMT, AIM: SUMM)组织的艰难梭菌感染(CDI)宣传月中,该公司向人们介绍了处于临床三期阶段的新型抗生素——利地利唑(Ridinilazole)。

利地利唑是一种新型的精准抗生素,主要用于治疗艰难梭菌感染。美国和欧洲每年有超100万名患者被诊断为 CDI,而治疗失败的原因是当前的抗生素疗法会破坏患者的肠道菌群。
Summit 公司研发总裁 David Roblin 博士介绍说:“我们的精准抗生素利地利唑可以对艰难梭菌进行靶向治疗,不会影响肠道中的有益菌,可以保护患者的肠道菌群平衡,改善 CDI 患者的预后。”
利地利唑目前正在进行两项全球三期临床试验,以评估其在 SCR 中与万古霉素相比的优势。数据预计将于2021年下半年公布。
在宣传月内举办的专题活动中,Summit 公司在报告中回顾了利地利唑与万古霉素对比的2期临床试验数据。数据显示,在 CDI 患者的临床治疗效果以及治疗后30天内是否复发的持续临床反应(SCR)的跟踪上,利地利唑取得了优于万古霉素的统计学优势。最终实验结果表明,与万古霉素相比,通过利地利唑治疗的患者,其肠道菌群得到了明显的保护。
利地利唑是一种口服小分子新型抗生素,不同于广谱抗生素或者像万古霉素这样的窄谱抗生素,它可以选择性地杀灭艰难梭菌,而不会对肠道菌群中的其它菌产生影响,从而保护了患者的肠道菌群,实现对 CDI 的持续治疗。
在针对 CDI 患者的概念性2期临床试验中,将 SCR 定义为治疗结束时临床治愈,治疗结束后30天内无复发。这项实验证明了利地利唑对肠道菌群有很好的保护作用,这被认为是利地利唑治疗的患者临床疗效改善的原因。
此外,在探索性2期临床试验中,利地利唑对肠道菌群的保护作用比已上市的新型窄谱抗生素非达霉素(fidaxomicin)更大。
利地利唑目前已获得美国食品和药物管理局(FDA)授予的治疗 CDI 的合格传染病产品(QIDP)资格和快速通道资格。这意味着利地利唑获批上市后,可获得额外5年的市场独占权。
编者注:
QIDP 是2012年7月美国《FDA 安全与创新法案》下的 GIAN 法案产生的新药特批通道,旨在激励抗生素研发,以应对严重威胁生命的细菌感染。简单说,QIDP=研究阶段快速通道(fast track)+审批阶段优先审评(priority review)+上市后5年额外市场独占权。
快速通道项目旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的医疗需求。实验性药物获得快速通道资格,意味着药企在研发阶段可以与 FDA 进行更频繁的互动,在提交新药申请(NDA)后也可能会获得 FDA 的优先审查。
本节参考资料:
Summit Therapeutics 官网(www.summitplc.com)
10月30日,Altasciences 代表委托方 Acurx 制药公司宣布完成了 ACX-362E 的首次人体试验。
Acurx 制药公司是一家临床阶段的生物制药公司,专注于开发新型抗生素,治疗难以治疗的感染。ACX-362E 是 Acurx 公司开发的一类新型 DNA 聚合酶 IIIC 抑制剂中的首个抗生素,用于治疗细菌感染。

目前,ACX-362E 正被开发为一种靶向、窄谱口服抗生素,用于 CDI 的治疗。与上文的利地利唑一样,ACX-362E 也已在今年1月获得了美国 FDA 授予的治疗 CDI 的快速通道资格和合格传染病产品(QIDP),同样获得上市后5年额外市场独占权。
ACX-362E 的临床试验是在美国 Altasciences 的临床药理学部进行。休斯顿大学医药学院教授 Kevin Garey 博士是此次人体试验的微生物组方面的首席研究员,他在10月份举办的的美国感染性疾病周(IDWeek2019)上介绍了该项研究结果。
Garey 博士在报告中特别说到,“首次试验中的安全数据令人印象深刻”。他解释说,试验中将 ACX-362E 和标准抗生素治疗对正常人体肠道菌群的影响进行了对比,微生物组分析表明,ACX-362E 对肠道菌群的干扰作用比口服万古霉素明显更小,尤其是对拟杆菌门和厚壁菌门的影响方面尤为明显,人体健康肠道菌群的90%是由这两个门的细菌组成。
Altasciences 的高级临床主任 Angela Phillips 博士说:“我们很高兴能与 Acurx 制药公司合作,为这种严重的、可能危及生命的肠道感染开发一种新的治疗方法。”
预计明年年初,ACX-362E 的二期临床将会正式启动。
(全文结束)


