编者按:
国内著名英文学术期刊 Protein & Cell 与热心肠研究院于去年再次合作,推出以“微生物组:迈向转化”为主题的人类微生物组专刊,邀请国内外有突出学术贡献的微生物组研究者和团队撰写综述文章,围绕微生物组分析方法、心血管疾病、代谢疾病、炎症性肠病、癌症和中医药等微生物组研究的热点领域展开探讨,共话人类微生物组研究的前沿进展。
今天我们发出来自阜外医院蔡军、北京朝阳医院徐立和北京大学第三医院薛丽香与团队的综述的翻译稿,以飨读者。(点击文末的“阅读原文”可获取综述原文)
翻译:金翎(本综述第一作者)
校对:储雪
心血管疾病中的肠道微生物及其潜在的治疗应用
Gut microbes in cardiovascular diseases and their potential therapeutic applications
第一作者:金翎1
通讯作者:蔡军4,徐立3,薛丽香1
其他作者:史晓明2,杨静2,赵扬玉2
1.北京大学第三医院基础医学研究中心医学创新研究所
2.北京大学第三医院妇产科
3.首都医科大学附属北京朝阳医院心脏中心,北京市高血压重点实验室
4.中国医学科学院&北京协和医学院国家心血管病中心,心血管疾病国家重点实验室,阜外医院高血压中心
摘要
微生物生态系统是一个细菌相互作用的复杂群落。肠道菌群在人类健康中的潜在作用已引起广泛关注。肠道微生物群落的不平衡已被认为参与多种慢性疾病。心血管疾病(CVDs)是全世界发病的主要原因,受遗传和环境因素的影响。最近的进展提供了科学证据,表明心血管疾病也可能归因于肠道菌群。在这篇综述中,我们强调了微生物之间复杂的相互作用、它们的代谢物,以及对心血管病的产生和发展的潜在影响。本文还讨论了利用肠道菌群治疗心血管疾病的潜力。肠道微生物很有可能在不久的将来用于心血管疾病的临床治疗。
1.概述
心血管疾病已是全球范围内影响人类健康的主要疾病,发病率和死亡率都位列前茅。心血管疾病的发生是遗传、环境等多种不良因素长期共同作用的结果,发病原因多样。
近期的研究揭示了肠道微生物在心血管疾病发生、发展中的作用。肠道内的微生物数量众多,远远超过了人体细胞总数,它们相互作用形成了一个复杂的有机体,甚至有人把肠道微生态视为人类的器官。从分娩开始,许多因素都会影响菌群微生态的组成、代谢和功能。肠道微生物菌群失调可通过免疫应答、肥胖、胰岛素抵抗、斑块形成等多种因素影响心血管疾病的易感性,它们也可以通过代谢产物作用于远端宿主器官。
本文将阐述肠道微生态及其代谢产物与心血管系统之间的相互作用,以及其在疾病发生、发展中的作用;此外,也将介绍几种治疗心血管疾病的靶向肠道微生态策略。
2. 肠道微生态紊乱与心血管疾病
菌群失调是指宿主—微生物之间相互作用的紊乱。微生物组成或其衍生物(如代谢产物或基因毒素)的变化均可影响病生理信号通路,最终直接或间接地影响疾病的易感性,导致心血管疾病。而这些成分也具有应用于靶向治疗的潜力。
2.1 肠道微生物组成的变化
肠道微生物组主要有四大类组成厚壁菌门、拟杆菌门、放线菌门和变形菌门。人体肠道微生态物中大多数为拟杆菌和厚壁菌,厚壁菌/拟杆菌也被视为衡量肠道微生物健康的一项指标。但是,肠道微生物组成存在个体差异,而且对于宿主和环境参数的变化十分敏感。有趣的是,宿主中条件致病菌(如大肠杆菌、梭状芽孢杆菌、粪便拟杆菌和迟缓埃格特菌)的丰度增加以及细菌源(罗氏菌、柔嫩梭菌、的短链脂肪酸的丰度减少,都与心血管疾病的风险增加有关。因此,微生物的种类及其相对丰度都是影响心血管疾病发生的重要因素。
自从引入了细菌的基因组学分析以来,针对微生物的研究已经产生革命性变化。16S rDNA 测序和宏基因组测序两种测序方法,常用于评估微生物组成机器相对丰度。16S 测序可以以可变区域周围的稳定区域为八项来检测细菌基因组中高变异度区域的差异。这一技术的主要缺陷在于无法分辨种群之间的差异,因为这种差异通常很小。相反地,鸟枪基因组测序能够实时检测所有生物的全基因组,这也造成针对意志和位置的微生物检测的精度增加。本章阐述了与心血管疾病相关的肠道微生物组成的变化。
2.1.1 动脉粥样硬化与肠道微生态
动脉粥样硬化是一种慢性炎症性疾病,其特征是血管细胞功能紊乱和低密度脂蛋白颗粒在斑块中的积聚。在同一个体的斑块和肠道中均发现了葡萄球菌属(Staphylococcus species)、变形杆菌(Proteus vulgaris)、肺炎克雷伯菌(Klebsiella pneumoniae)和链球菌属(Streptococcus species),表明肠道微生态参与动脉粥样硬化的形成。
某些肠道细菌被认为是动脉粥样硬化疾病进展的新因素。研究发现,中国动脉粥样硬化患者的类杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)相对减少,而链球菌属(Streptococcus)和大肠埃希菌属(Escherichia)富集。然而,在波兰东部,总胆固醇水平和低密度脂蛋白胆固醇值高的中年男性肠道中富含普雷沃氏菌属(Prevotella),但是梭菌属(Clostridium)和粪杆菌属(Faecalibacterium)含量较低。例如,一些动脉粥样硬化患者的条件致病菌柯林斯氏菌属(Collinsella)增多。同时,有些微生物也可以降低动脉粥样硬化斑块的形成。比如,在患者和小鼠模型中均发现,产丁酸盐的细菌罗斯伯里氏菌属(Roseburia)和真杆菌属(Eubacterium)的相对减少与动脉粥样硬化病变的发展呈负相关关系。据推测,这些微生物可能会影响宿主的炎症水平。
动脉粥样硬化斑块样本中,细菌群落与总胆固醇、丙氨酸转氨酶和纤维蛋白原水平等临床参数相关,这些肠道微生物可能影响宿主的炎症状态。此外,多种细菌都会影响斑块的形成和稳定。然而,哪些种属在疾病中起主导作用,目前尚不清楚。探索微生物群影响动脉粥样硬化发展的机制是未来研究的热点。
2.1.2 高血压与肠道微生态
高血压是心血管疾病的常见病因。在观察抗生素治疗对大鼠血压的影响时,首次观察到肠道菌群参与高血压发病机制的证据。随后,在多种高血压动物模型和患者中均发现了粪便中细菌丰度、多样性和均匀度的减少。此外,高血压的严重程度也被发现与疾病相关细菌的数量、厚壁菌/拟杆菌比率的增加、条件致病菌(如克雷伯氏菌属、链球菌属)丰度的增加,以及乙酸/丁酸盐产生菌数量的减少有关。据报道,高血压前期人群和高血压人群的肠道微生物特征相似,普雷沃氏菌属和克雷伯菌属在两组中都有明显的增多。对于一些具有较高风险患妊高征和子痫前期的妇女而言,丁酸盐产生菌(如:气味菌属 Odoribacter)和丁酸盐产生的增多与血压呈负相关。
高血压肠道微生物表现为膜转运、脂多糖生物合成和甾体降解的增加。菌群失调可能部分由于维生素 D3 缺乏所致。尽管已经探明肠道微生物引起血压升高的部分因素,但其中深入的机制仍有待阐明。
表 1 与心血管疾病相关的微生物组成变化
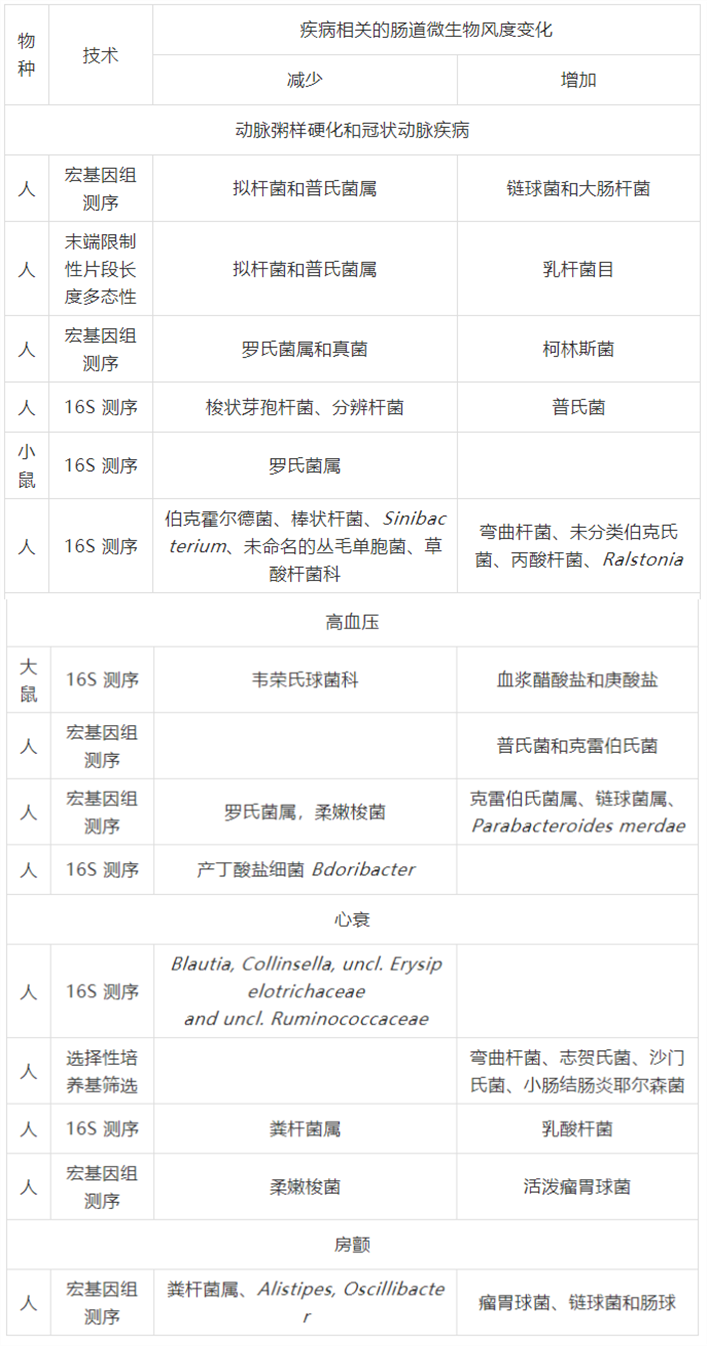
2.1.3 心衰与肠道微生态
心衰是心脏泵血和氧气的能力不足以维持机体需要的一种疾病,通常出现在心血管疾病的临床终末期。心衰患者的肠道微生物的组成会发生改变。心衰相关的多系统紊乱常表现为肠屏障功能受损,这可能导致肠道微血管与宿主肠黏膜相互作用的增强,随后导致循环脂多糖水平的增加和下游炎症反应的激活。比如,合并心衰的患者更易发生艰难梭菌(Clostridium difficile)感染。
针对心衰患者的队列研究中发现,他们的肠道微生物多样性降低、丁酸盐生产菌减少。心衰患者粪便中分离出的致病性细菌增多【如弯曲杆菌属(Campylobacter)、志贺氏菌属(Shigella)、沙门氏菌属(Salmonella)】,直肠真杆菌(Eubacterium rectale)减少。此外,在部分左心室射血分数显著降低的心衰患者中,布劳特式菌属(Blautia)、柯林斯氏菌属(Collinsella)、丹毒丝菌(unidentified Erysipelotrichaceae)和粪杆菌属(Faecalibacterium)等细菌丰度显著降低。慢性心力衰竭患者的普拉梭菌(Faecalibacterium prausnitzii)减少,活泼瘤胃球菌(Ruminococcus gnavus)数量增加。心衰患者的肠道微生物态也因年龄而异。与年轻患者相比,老年患者通常缺乏粪杆菌属(Faecalibacterium),但乳酸菌属(Lactobacillus)丰富。
2.1.4 房颤与肠道微生态
房颤是心率失常最常见的症状之一,在房颤患者中已经观察到肠道微生物的紊乱和特定变化。研究报道,房颤患者中瘤胃球菌、链球菌和肠球菌增加,粪杆菌属、另枝菌属、颤杆菌和嗜胆菌属减少。在两例持续性房颤患者中,都观察到肠道微生态的生物多样性增加以及菌群组成结构的差异。
2.2 血液中微生物组成的变化
过去,血液被认为是无菌环境,在大部分健康的情况下不含有任何的微生物。但是,越来越多的证据表明了血液中微生态的存在。健康人的血液中主要微生物为变形菌门,而肠道微生物则以厚壁菌门和拟杆菌门为主。微生物进入血液的途径,一般被认为是来自微生物较为丰富的器官(如肠道)或是来自产前的菌群转移。
动脉粥样硬化的斑块中微生物定植可能来源于血液循环中的微生物,并随后造成了验证与心血管疾病的发展。心血管疾病的患者被发现血液中的微生物数量增加,其中变形菌门和假单胞菌门的数量显著增加,厚壁菌门数量显著减少。
在先天性心脏病(CHD)、心脏瓣膜疾病和缺血性心脏病(IHD)患者的血液中发现葡萄球菌的数量增加。有报道称,ST 短抬高型心肌梗死(STEMI)患者的肠道微生物转为进入血液循环,并驱动造成心血管疾病的结局。这些心肌梗死患者中也发现乳杆菌、拟杆菌和链球菌属的丰度增加,可能是由于肠道屏障的紧密连接中断造成的。血液循环中的微生态变化可能也造成了慢性感染和免疫反应,并造成心血管疾病的发生。
2.3 微生物代谢产物的变化
肠道中有许多微生物代谢产物,如维生素、激素、短链脂肪酸、氨基酸衍生物和抗氧化剂。这些代谢物可以直接吸收进入宿主循环系统,然后迁移至不同的器官;或者,它们可能被宿主酶代谢,产生信号分子。在健康个体中,大多数微生物的代谢产物都可以发挥协同作用。
2.3.1 短链脂肪酸
人类肠道无法消化以膳食纤维形式存在的复杂碳水化合物,但肠道微生物能够利用膳食纤维进行发酵,并产生短链脂肪酸。短链脂肪酸是一种饱和脂肪酸,含有 1~6 个碳链。人体中的短链脂肪酸主要由乙酸、丙酸和丁酸组成。在抗炎反应、脂质代谢途径和糖异生通路中,短链脂肪酸扮演着关键的角色。此外,这些短链脂肪酸分子,特别是丁酸盐,被视为肠道上皮细胞的能量底物。
肠道微生态对心血管系统具有潜在调节作用,而血液循环中的短链脂肪酸能介导这一过程。大量研究表明,肠道菌群产生的丁酸钠和丙酸钠,与肾素受体介导的肾素-血管紧张素系统的功能呈负相关,且有助于降低血压。从功能上讲,进入血液的短链脂肪酸可通过 G 蛋白偶联受体(GPCRs)介导血压的改变。嗅觉受体 78(Olfr78)和G蛋白偶联受体 41(GPR41)就是这样的两种受体。这两种受体都定位于阻力血管,但对血管张力有着不同的作用。在短链脂肪酸的刺激下,GPR41 作为一种降压蛋白,通过内皮依赖的方式扩张阻力血管,而 Olfr78 则可以对抗这种降压作用。Olfr78 和 GPR41 这两种受体为机体提供了必要的平衡,能防止健康状态下血压的过度改变。此外,微生物源的短链脂肪酸也被报道能够在减轻氧化应激和维持免疫系统功能方面发挥免疫调节作用。已有研究证明,在饮食中添加 1%丁酸盐,可以通过其抗炎功能和增强斑块稳定性来减缓动脉粥样硬化疾病的进程[45]。通过 T 细胞依赖的方式,丙酸盐可以减轻心肌细胞肥大和心肌纤维化。
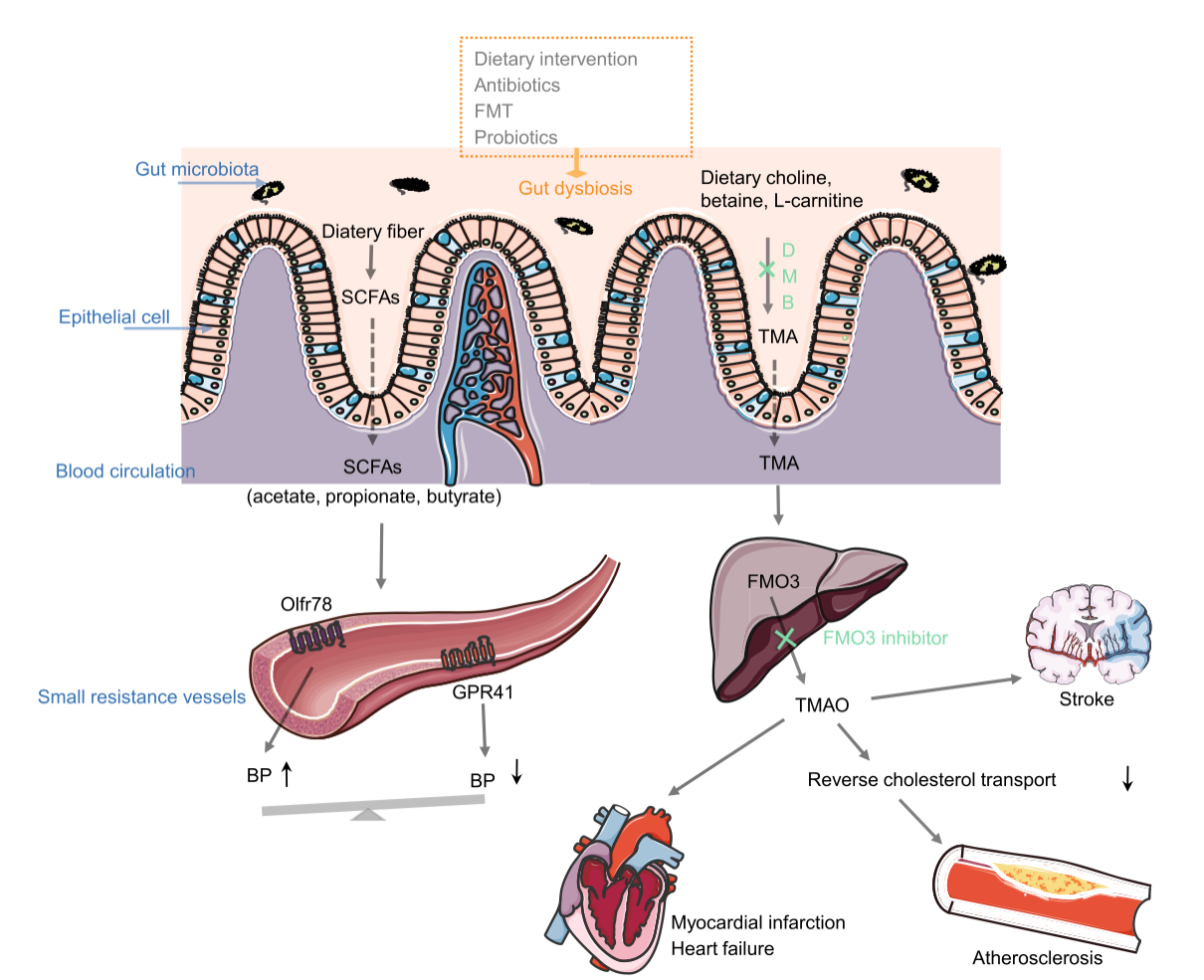
图1.心血管疾病发病机理中的微生物相关的代谢产物
营养物质可以被肠道菌群代谢为 TMA,而 DMB 会一直 TMA。大部分 TMA 会被吸收进入血液循环,然后经由肝脏的 FMO3(黄素单氧酶)转化为 TMAO。血液中的 TMAO 可能是心梗、心衰、外周动脉疾病等的指征。一些肠道微生物的代谢产物,如短链脂肪酸,可以通过与 Olfr78 和 GPR41 结合来调节血压。以微生态为靶点的治疗策略可以改善肠道微生物的失调。
2.3.2 氧化三甲胺(TMAO)
在微生物代谢产物中,作为心血管疾病的一个主要因子,TMAO 受到了广泛的关注。TMAO 是三甲胺(TMA)的肝脏氧化产物,主要来源于饮食中胆碱和磷脂酰胆碱的细菌代谢。在无菌小鼠和人群研究中,血浆 TMAO 水平与心血管疾病风险因素之间存在正相关。给小鼠喂食富含胆碱和肉碱的饮食后,小鼠的血浆 TMAO 水平升高、动脉粥样硬化斑块明显;而饮食缺乏胆碱或肉碱则能使 TMAO 的产生减少,并减轻动脉粥样硬化斑块。因此,血浆中的 TMAO 可以作为心血管疾病诊断的有效指标。目前,TMAO 被认为是独立的心脏危险因素,TMAO 水平增高可能表明心梗、心衰、外周动脉疾病、中风、冠状动脉疾病等的发生风险增加。服用广谱抗生素后,个体的肠道微菌群会减少,且血浆 TMAO 水平显著下降。此外,由于饮食是 TMAO 的主要来源,建议个人避免过多食用富含肉碱、胆碱和卵磷脂的食物,以降低患心血管疾病的风险。
研究表明,TMAO 与血浆中脂肪、胆固醇的代谢变化有关。体内外实验也揭示了 TMAO 在血管功能障碍、免疫反应和氧化应激中的可能机制。现已发现,内质网应激激酶 PERK 是 TMAO 的受体。有意思的是,据报道,TMAO 可能对于血管损伤的血液透析患者具有保护作用,部分原因是其对 AGE 的抑制作用。
胆碱类似物可降低血液循环中 TMAO 的水平。3,3-二甲基-1-丁醇(DMB)是一种广泛存在于葡萄藤、红酒和葡萄籽油中的天然化合物,已被发现能抑制微生物的胆碱-TMA 裂解酶活性。这种化合物可以抑制 Apoe 敲除小鼠动脉粥样硬化病变的发展,同时不改变循环胆固醇的水平。其他胆碱类似物,如氟甲基胆碱、氯甲基胆碱、溴甲基胆碱、碘甲基胆碱,也都被报道可以作为有效的 TMA 裂解酶抑制剂降低血浆 TMAO 水平。
2.3.3 其他代谢物
苯丙氨酸、色氨酸和酪氨酸是芳香族氨基酸,可影响免疫、代谢和神经反应。苯丙氨酸是一种必需氨基酸,是酪氨酸的前体,可以进一步转化合成神经递质、去甲肾上腺素和肾上腺素。色氨酸也是一种必需氨基酸,是神经递质血清素的前体。晚期动脉粥样硬化患者的血浆中,微生物的色氨酸代谢物显著降低。最近一项研究表明,苯丙氨酸及酪氨酸的肠道菌群代谢物可能与大鼠心梗的严重程度有关。今后,对于这些芳香族氨基酸代谢物与心血管疾病之间的联系仍需要进一步深入研究。
苯乙酰谷氨酰胺(PAGln)是由膳食苯丙氨酸转化为苯乙酸而产生的,已被报道与心血管疾病和主要心血管不良事件有关。肠道细菌产生的这一代谢产物通过肾上腺素受体,促进血小板活化相关表型和血栓的形成。
2.3.4 知识空白
近来的研究已凸显微生态失调在心血管疾病中的潜在作用。基因组学和代谢组学方法的进步促进了对这些微生物组及其代谢产物更为深入的表征与机理的研究。但是,大部分数据在进行相关性研究,而大部分观察到的现象背后的分子机制仍然未知。未来,针对微生物之间、微生物与宿主之间的相互作用研究或可阐明某些代谢产物是如何调节疾病发生过程的。更深入地了解心血管疾病代谢产物地生物合成中的微生物通路,以及及这些代谢产物地功能性作用,也很重要。这些研究的结论或可为用于预防和治疗针对心血管疾病患者的治疗措施提供必要的理论依据。
3. 针对菌群微生态的靶向治疗
越来越多的证据表明,肠道微生物菌群在心血管疾病的发展中起着重要的作用。因此,肠道菌群或已成为疾病预防和治疗的理想靶点。旨在调节肠道微生物群组成和/或其代谢的治疗策略已经逐渐产生,包括饮食干预,益生菌、益生元、抗生素治疗以及粪便移植等。这些策略已经改善了部分心血管疾病患者的血压、血脂、体重。
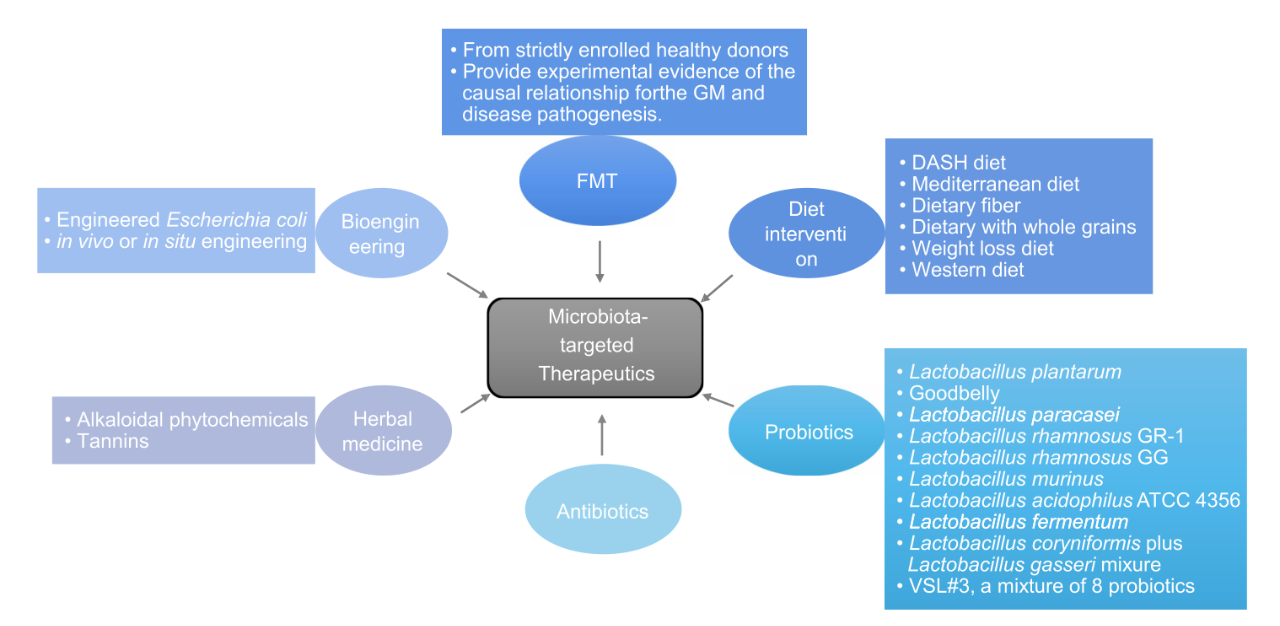
图2. 与肠道菌群复原和心血管疾病改善相关的潜在干预措施
本综述中讨论了 6 中主要策略,包括饮食干预、益生菌、抗生素、粪菌移植、生物工程和草药。
3.1 饮食干预与菌群微生态
饮食干预已经广泛应用于缓解慢性疾病。例如,富含蔬菜和高纤维的健康饮食被认为对心血管系统有益。地中海饮食和 DASH 饮食(富含水果、蔬菜、豆类和不饱和脂肪和有限的红肉摄入量)被认为可以降低心血管疾病高风险人群的发病率。
人们普遍认为,饮食习惯会影响肠道微生物的组成和功能,通过调节营养物质的消化吸收来调节人体健康,这种影响可以持续终生。膳食纤维可能改变宿主微生物的组成。给小鼠喂以高纤维饮食后,小鼠的醋酸产生菌酸性拟杆菌(Bacteroides acidifaciens)数量增加、心血管易感基因减少,疾病相关的功能改善。摄入较少膳食纤维可能造成微生物多样性的减少及短链脂肪酸的降低,同时对粘膜蛋白有害的代谢产物生成增多。据预估,膳食纤维缺乏引起的结肠粘液屏障功能受损是易感性增加的原因之一。地中海饮食者表现出较低的心血管疾病发病率,粪便中降解短链脂肪酸和纤维的厚壁菌门含量增多。多吃全谷类食物可以改善血脂和血压,减少条件致病菌肠杆菌科(Enterobacteriaceae)细菌的数量,同时增加能够保护肠道屏障的双歧杆菌科细菌(Bifidobacteriaceae)的含量。用于减肥的高蛋白低可发酵碳水化合物的饮食,可以增加丁酸盐产生菌罗斯氏菌(Roseburia)和直肠真杆菌(Eubacterium rectale)的丰度。然而,富含饱和脂肪、糖分和较少纤维的西方饮食与心血管疾病风险的增加有关。这种饮食减少了微生物的多样性,降低了有益双歧杆菌属(Bifidobacterium)和真杆菌属(Eubacterium)的数量,同时增加了 Akkermansia muciniphila 菌的丰度,促进了 T 辅助细胞 17(TH17)的活性。
在心血管疾病的预防和治疗中,饮食干预是一种成本较低、易于管理的方式。尽管通过饮食干预能影响肠道微生物的代谢产物,并使其作用于多个组织和靶点,但这种方式的多数机制仍不十分清楚。基于肠道微生态的饮食干预,效果不尽相同,这是因为肠道微生物的组成及其功能具有个体差异性,除了食物成分外,烹调方法和所用食材成份的多样性也会有一定影响。
3.2 抗生素与菌群微生态
抗生素可以调节和恢复微生物菌群,以预防和治疗心血管疾病。据报道,经联合抗生素治疗后,一位有着 44 年顽固性高血压病史的 69 岁患者血压下降。用广谱抗生素鸡尾酒疗法进行为期 2 个月的饮食干预,能逆转西方饮食引起的血管功能障碍,从而减缓心血管疾病的发展过程。而且,使用万古霉素可减少心肌梗死面积(约减少 27%),改善缺血后的功能恢复过程(35%)并有效减少肠道微生物的总数和类群。
虽然抗生素常用于对抗细菌,但它对寄生菌和共生菌的作用没有区别。因此,抗生素治疗可能会诱导耐药菌的出现,随后造成微生物菌群的失调和微生物耐药性的产生。在一项包括 33 例研究共 20779963 名参与者的荟萃分析中发现,大环内酯类抗生素的使用与心源性猝死或室性心律失常的风险增加有关。未来的研究需要迫切优化抗生素在心血管患者中的应用。
3.3 益生菌与菌群微生态
益生菌是能够帮助建立正常的肠道微生物平衡的有益的细菌。临床试验的荟萃分析发现,益生菌治疗能够有效降低总胆固醇、低密度脂蛋白胆固醇水平、改善血压并调节炎症细胞因子。双歧杆菌(Bifidobacterium spp.)和乳酸杆菌(Lactobacillus spp.)是应用最广泛的益生菌。
植物乳杆菌(Lactobacillus plantarum)是一种以发酵植物性食品形式存在的益生菌。给大鼠喂食这种菌后,大鼠的细菌移位减少、粘膜炎症反应减弱,大肠杆菌属(Escherichia)和沙门氏菌属(Salmonella)数量增加。饮食中摄入植物乳杆菌能有效降低血清中瘦素和纤维蛋白原这两种心血管疾病风险因素的含量,从而降低吸烟者动脉粥样硬化疾病的发生。动脉硬化患者饮用富含植物乳杆菌的饮料可以增加益生菌的多样性。同样,摄入含有植物乳杆菌 299v 和乳双歧杆菌 Bi07 的 GoodBelly 饮料后,可以显著减少心肌梗死后梗死面积,并改善左心室功能。
乳制品中富含副干酪乳杆菌(Lactobacillus paracasei)和鼠李糖乳杆菌(Lactobacillus rhamnosus)。服用鼠李糖乳杆菌 GR-1 有助于减轻心肌梗死后左室肥厚,并改善左室收缩和舒张功能。鼠李糖乳杆菌 GG 可通过调节肠道菌群改善动脉粥样硬化症状。
其他乳酸菌属的益生菌也对心血管疾病的预防和治疗起着积极的作用。经鼠乳杆菌(Lactobacillus murinus)干预的小鼠,对高盐诱导的血压升高具有抵抗性,其中部分机制可能通过抑制 TH17 细胞介导。嗜酸乳杆菌 ATCC 4356(Lactobacillus acidophilus)能够通过抑制 ApoE 敲除小鼠肠道中胆固醇的吸收,从而预防动脉粥样硬化症状 。VSL#3 是由 8 种具有抗炎潜力的益生菌组成的混合物,研究表明,VSL#3 可降低超重人群出现动脉粥样硬化斑块破裂和血管炎症的风险,同时改善血脂异常的情况。
但是,益生菌的益处仍然存在争议。部分动物实验和人体临床试验表明,益生菌对心血管疾病无益。造成差异的部分原因与益生菌菌株、剂量有关,此外,实验参与者的异质性也可能与之相关。迄今为止,大多数益生菌研究都集中在特定疾病的患者人群中,益生菌对健康个体的作用还需要进一步的研究确定。
3.4 粪便微生物菌群移植与菌群微生态
粪便微生物菌群移植(FMT)是一种将供者粪便样本转移至肠道的治疗策略,目的是恢复患者正常的肠道微生物菌群。根据移植的来源,FMT 可分为同种异体 FMT(来自健康供体的粪便)和自体 FMT(患者接受自己的粪便),其中,同种异体 FMT 是最常见的。粪便微生物可在实验室中通过四种不同的方法制备:粗滤、过滤+离心、微滤+离心、纯化,这些方法可以缩短处理时间,以减少活菌的损失。粪便微生物群移植的部位包括消化道上段、中段和下段。菌群胶囊可以通过消化道上段给药,而菌群悬液则可以通过结肠经内镜肠管进入消化道下段。
粪便微生物菌群移植最先应用于肠道疾病的治疗,如艰难梭菌感染(Clostridium difficile)和炎性肠病的治疗。有证据表明,FMT 治疗复发性艰难梭菌感染,效果明显优于抗生素治疗。最近,粪便微生物菌群移植策略也成功地应用于心脏代谢紊乱的患者。有趣的是,在首次注入瘦者的肠道微生物后,患有代谢综合征的肥胖患者对胰岛素的敏感性显著增加。
粪便微生物菌群移植也为探索肠道菌群在疾病发生发展中的作用提供了直接的证据。在这些研究中,人们通常将健康个体和患病个体的粪便微生物菌群移植到无菌啮齿动物体内,然后分析受体动物的病理生理学变化。在接受粪便移植后,大多数受体动物会出现疾病表型,但是一些研究中仅仅使用少量的患者供体,然后通过将这些供体细菌在大量受体小鼠中复制以得出阳性结论。此外,人类肠道菌群中有相当大比例的菌群无法在受体动物中定殖,这表明受体啮齿动物可能不存在能促使人的肠道微生物菌群生长的因子。因此,人类疾病引起的改变是复杂的,很难在啮齿动物身上完全复制。
尽管粪便微生物菌群移植在一些患者中得到了成功的应用,但在其广泛应用之前,还必须进行仔细评估。首先,FMT 治疗可以同时改变有害细菌和益生菌的水平,因此,受体可能会出现不良反应。第二,整个消化道的微生物菌群是多样的,因此需要尽可能获得最具代表性的供体样本。第三,在 FMT 治疗过程中,内毒素或其他感染因子可能会导致新的胃肠道并发症。最后,一系列的伦理问题进一步使得 FMT 的实施复杂化,应为所有患者仔细考虑相关因素,如签署知情同意、合适的健康供者、菌群移植的安全性和风险性等。因此,必须建立一个完善的系统来监控 FMT 流程、保护病人和捐赠者,以促进 FMT 的发展,并防止此技术滥用。
3.5 生物工程与菌群微生态
细菌可以经过基因改造获得所需的特性,如特定的代谢活性和终产物。因此,可以改造细菌以产生更有益的效果。目前,临床上正在进行改造大肠埃希菌(Escherichia coli),使其表达特定基因,以缓解罕见代谢性疾病。比如,由于苯丙氨酸是造成人类苯丙酮尿症疾病的原因,经改造的大肠杆菌菌株 SYNB1618 可以表达产生能够降解苯丙氨酸的蛋白质。除了以上提到的在实验室中改造的菌株外,体内和原位工程方法也正在逐步发展。这些手段和由此产生的微生物细菌正在开创一个精确治疗肠道菌群疾病的时代。
3.6 草药
草药是植物源的原料,大多通过口服,已经长期临床实践证明其有效性。尽管对于草药对肠道微生物组的影响,研究仍处于初级阶段,但现阶段的发现鼓励使用这些药物来帮助治疗肠道微生物组相关的疾病。
黄连,是毛茛科药用植物的干燥根茎,含有小檗碱、黄连素和巴马汀等生物碱。给高脂血症小鼠喂食 RC 生物碱可显著改变肠道菌群,增加 Akkermansia muciniphila、Sprobacter termitidis 和 Alcaligenes faecalis 的丰度并降低副拟杆菌和大肠杆菌的丰度。高脂饮食诱导的高血脂大鼠的大肠杆菌数量减少,有益菌水平增加。生物碱植物苏可以同时调节肠道菌群和胆汁酸通路来降低小鼠的甘油三酯、血浆胆固醇、LDL、脂多糖和胆汁酸水平。
柿子丹宁(PT)是一种缩合单宁,会在肠道内高度聚合而不被吸收。据报道,这种丹宁可以通过与大肠菌群微生态直接的相互作用来调节肠道细菌组成。这种化合物对高胆固醇饮食的 SD 大鼠具有抗高血脂症和降低胆固醇作用,这可能部分经由肠道微生物组成的变化调节,如乳杆菌属和双歧杆菌属数量的增加以及大肠杆菌和肠球菌数量的减少。
4. 展望
越来越多的证据表明肠道微生物群与心血管疾病发病率之间存在联系。研究表明,微生物菌群通过多种途径与宿主相互作用,它们的组成或代谢产物的异常可能是导致心血管疾病病理变化及风险增加的原因。因此,针对肠道微生物菌群目前也已开发了预防和治疗心血管疾病的新的治疗靶点/策略。
目前微生物族在心血管及其他人类疾病的潜在应用正在大力推进中。首先,为了阐明特定微生物在疾病进展中的作用,应该鉴定特定的微生物菌株而非一般的微生物群。其次,目前的研究主要研究了微生物组成,未来的研究应更多的关注微生物介导的代谢产物及其下游产物的功能性影响。第三,我们迫切地需要个性化的微生物调节方法,分析个体患者的微生物组或许能够帮助获取他们的代谢组生物标志物。
(翻译全文结束,参考文献请见综述原文,可点击“Gut microbes in cardiovascular diseases and their potential therapeutic applications”跳转至论文页面获取。)


